La investigación biomédica utiliza modelos animales para estudiar enfermedades que afectan a las personas. ¿Puede utilizarse este método para estudiar enfermedades de la mente?
Muchos investigadores utilizan animales para estudiar los procesos biológicos. Eso se denomina emplear modelos animales. Quienes trabajan en enfermedades psiquiátricas se plantean a menudo preguntas como ¿podemos encontrar o criar ratones autistas, ratas esquizofrénicas, ratones depresivos? Desde hace años se emplean modelos animales y cultivos celulares para estudiar enfermedades como el cáncer, pero cuando se trata de dolencias de la mente impera cierto escepticismo sobre su efectividad.
Esto no es nuevo. Las enfermedades psiquiátricas siempre fueron difíciles de estudiar científicamente. Antes de la aparición de técnicas que hacen visible el funcionamiento del cerebro, como la resonancia magnética, ese órgano humano era analizado como si se tratara de la proverbial caja negra, que brinda determinadas respuestas a estímulos externos, pero no se sabe cómo produce esos resultados. El único acercamiento al cerebro en el pasado eran los estudios histológicos post mórtem, cuando ya sus células no vivían.
Siglos de investigaciones de la conducta animal permitieron no solo comprender algunas de las bases neuronales de comportamientos básicos –como la búsqueda de comida, la respuesta a un predador o el apareamiento– sino, también, comenzar a formular hipótesis acerca de qué estructuras y mecanismos similares a los que emplean los animales participan de las respuestas del propio cerebro humano al hambre, al peligro y al deseo. Fue probablemente en ese momento cuando la neurobiología dio un gran paso adelante en la comprensión de numerosos fenómenos.
El autismo y los modelos animales
El concepto de autismo ha cambiado considerablemente desde 1943, cuando el psiquiatra norteamericano (nacido en lo que hoy es Ucrania) Leo Kanner (1894-1981), de la Universidad Johns Hopkins, lo definió por vez primera. En ese momento se consideró que el autismo consistía en la respuesta del niño a la privación materna o a alteraciones en la relación madre-hijo, según la llamada teoría de las madres refrigeradoras. En la década de 1970 se definió el autismo como un desorden particular del desarrollo cerebral. Hoy, luego de años de estudios de pacientes autistas, se habla de un espectro del autismo, que abarca desde individuos que carecen de lenguaje, a quienes les es muy difícil integrarse a la sociedad, hasta otros que apenas exhiben algunas dificultades en mantener relaciones sociales.
A partir de la publicación en 1994 de la cuarta versión del Manual de diagnóstico y estadística de desórdenes mentales por parte de la Sociedad Americana de Psiquiatría, se establecieron tres criterios de diagnóstico para el desorden autista, definidos por las siguientes características:
- Alteraciones significativas de la interacción social, que incluyen falta de uso de formas de comunicación no verbal, como gestos y posturas corporales, y falta de reciprocidad emocional o empatía.
- Alteraciones cualitativas de la comunicación, como falta de lenguaje, problemas para iniciar o mantener una conversación y la utilización estereotipada y repetitiva del lenguaje.
- Patrones de comportamiento, intereses y actividades estereotipadas y repetitivas, como interés excesivo en un objeto o tema, y movimientos repetidos del tipo de sacudir y agitar las manos.
Sobre la base de las características deseables de los modelos animales de enfermedades psiquiátricas (véase recuadro ‘Modelos animales’) se comenzó a evaluar la posibilidad de utilizar ratones y ratas para estudiar el autismo. Si el autismo tiene los tres tipos de síntomas indicados, es entonces esperable que su modelo animal exhiba:
- Deficiencias de sociabilidad. Los ratones son animales sociables: cuando se encuentran con uno que no conocen, por lo general pasan bastante tiempo oliéndolo y explorándolo. Si un ratón se muestra indiferente a otro desconocido, exhibe una conducta que no es normal en la especie. Hay distintas formas de evaluar la sociabilidad de los ratones, la más simple de las cuales es poner a dos en una caja, medir el tiempo que pasan olfateándose y caracterizar cómo interaccionan. Cuanto menor sea el tiempo de interacción, menos sociables son.
- Comportamientos repetitivos y estereotipados. Los ratones buscan constantemente la novedad: es raro que se queden repitiendo una actividad sin un objetivo específico relacionado con comer, reproducirse o buscar cobijo. Por eso los ratones modelo deberían pasar más tiempo que ratones normales en actividades que juzguemos sin sentido para ellos. Se han diseñado ensayos para evaluar la presencia de comportamientos estereotipados, como enterrar en aserrín bolitas de vidrio que se les pongan en su jaula. Los ratones que lo hacen sistemáticamente y en corto lapso exhiben mayor comportamiento repetitivo, pues no sacan ventaja evidente de la actividad. Algo similar ocurre con el acicalamiento: los ratones cada tanto se limpian los bigotes y la cara, además del resto del pelo, pero también lo hacen cuando están en situaciones estresantes, en las cuales no tiene mucho sentido limpiarse. Varios investigadores han propuesto utilizar el tiempo que los ratones pasan acicalándose cuando son expuestos a un ambiente novedoso como medida de comportamiento repetitivo.
- Deficiencias en el lenguaje. Este tal vez sea el síntoma más difícil de encontrar en los animales modelo. La autora y otros investigadores consideramos que no es posible hacerlo en roedores, pues estos no tienen un lenguaje complejo como el nuestro. ¿Utilizan vocalizaciones para comunicarse? El tema está en discusión, aunque hay investigadores que evalúan las vocalizaciones de los ratones en distintas situaciones y procuran establecer si es así.

Si un ratón se muestra poco sociable, aparece acicalándose por largos períodos y vocaliza de manera extraña, podríamos decir que sirve como modelo para el autismo, o por lo menos, para estudiar los fenómenos biológicos que subyacen en las alteraciones en el comportamiento que definen la enfermedad. En tal caso diríamos que su validez aparente como modelo es grande o, quizá más en broma que en serio, que hemos dado con un ratón autista.
Dos líneas de investigación
Dada la complejidad de las enfermedades psiquiátricas, una forma de encarar la búsqueda de modelos animales para estudiarlas es procurar que estos solo exhiban algunos síntomas específicos asociados con ellas, en lugar de la totalidad de sus síntomas (véase recuadro ‘Criterios que debe cumplir un buen modelo animal de una enfermedad psiquiátrica’). En esos casos se busca estudiar en los animales de experimentación ciertos comportamientos observados en las poblaciones psiquiátricas. Dichos comportamientos no necesariamente deben ser los signos clínicos o síntomas que determinan el diagnóstico de la enfermedad, pero deben ser definidos objetivamente y medidos de manera confiable.
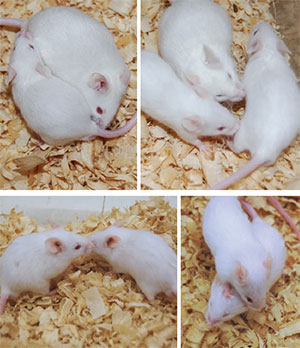
Si la sociabilidad se puede estudiar fácilmente en los ratones, podremos analizar cómo distintos tratamientos afectan esa sociabilidad. Si bien un ratón menos sociable no puede calificarse sin más de autista, igual tiene interés estudiar los fenómenos biológicos que llevan a la disminución en su sociabilidad, por ejemplo, identificar los genes que la modulan. Si bien esto limita la utilidad del modelo animal, la comparación con humanos resulta mucho más confiable y el enfoque, pese a sus limitaciones, tiene ventajas pragmáticas para estudiar los mecanismos neurobiológicos responsables de las conductas que nos interesan.
Pero como en el autismo, como en la mayoría de las otras enfermedades psiquiátricas, no sabemos las causas que llevan al desorden, cualquier declaración acerca de la validez de un modelo será, a lo sumo, solo parcialmente válida. A pesar de esto, se han intentado distintos acercamientos, de los que comentaremos, a modo de ejemplo, un modelo de orientación farmacológica y uno de orientación genética.
Un modelo farmacológico
Distintos estudios clínicos han concluido que la exposición intrauterina al anticonvulsivo valproato (ácido valproico) está asociada con un aumento en la incidencia de autismo. En particular, se estableció que los niños de madres epilépticas tratadas con ese fármaco tenían más posibilidades de sufrir problemas de sociabilidad y comunicación que los de madres no tratadas. Los trastornos en cuestión son muy similares al autismo, pero en este caso se denominan síndrome de valproato fetal. Esos estudios llevaron a desaconsejar la administración de valproato a epilépticas embarazadas. También llevaron a que se utilizara esa información para tratar de crear con roedores modelos animales orientados al estudio del autismo, de forma parecida a lo que ocurrió con el mal de Parkinson (véase recuadro ‘La historia de un modelo del parkinsonismo’).
Desde 2005 distintos investigadores han mostrado que tanto ratas como ratones expuestos a dosis de valproato de 600mg/kg en el día 12,5 de gestación (las ratas tienen una gestación de 20-22 días y los ratones de 19-21 días) muestran en la adultez una disminución en las interacciones sociales. Tenemos así un modelo del síndrome de valproato fetal con fuerte validez de construcción y de apariencia. Si bien solo estamos empezando a utilizarlo, consideramos que serviría para tratar de entender los mecanismos biológicos que producen la alteración constatada, y para ensayar posibles tratamientos que la reviertan.
MODELOS ANIMALES
En la investigación biomédica se da ese nombre a cualquier animal usado para estudiar enfermedades humanas. El procedimiento evita
experimentar directamente con un ser humano –y posiblemente causarle daño–. Para ser un buen modelo, el animal elegido debe tener parecido con los seres humanos, sobre todo, poder experimentar la enfermedad en cuestión o alguno de sus síntomas. El objetivo perseguido determina los criterios a tener en cuenta para elegir el modelo animal.
Si, por ejemplo, se requiere un modelo para un síndrome psiquiátrico, hay que encontrar una situación de homología entre el comportamiento del animal escogido y el síndrome que se procura modelar. un modelo homólogo sufre la misma enfermedad humana, por iguales causas, con los mismos síntomas y responde de forma semejante a idénticos tratamientos. Por ejemplo, existe una raza de ratones
que enferman de diabetes; se llaman los ratones NOD (diabéticos no obesos) y permiten estudiar la enfermedad humana, analizar sus causas genéticas y sus síntomas, y evaluar posibles tratamientos.
En los inicios de la psicofarmacología, el término ‘modelo animal’ solía significar ese tipo de modelos. Pero pronto se hizo evidente
la dificultad de encontrar animales que sirvieran para enfermedades psiquiátricas: las similitudes son difíciles de establecer porque, a diferencia de los humanos, los animales no pueden explicar cómo se sienten ni qué experimentan, y muchas veces esa es la forma en que los psiquiatras diagnostican las enfermedades. Así, es difícil encontrar
un animal que sufra falta o deficiencias del lenguaje, que es uno de los síntomas del autismo.
un propósito más limitado de los modelos animales es estudiar los efectos de posibles tratamientos y ayudar a que se descubran nuevos. Del análisis de la conducta de los ratones, por ejemplo, se concluye que si se los pone en una habitación vacía tienden a caminar pegados a las paredes, donde están más protegidos de predadores. Pero como son también curiosos, buscan investigarlo todo, aun el centro de la habitación, donde están más expuestos. En un recinto desconocido, experimentan el conflicto entre quedarse a resguardo, cerca de las paredes, o explorar todo el espacio, incluido el centro, donde tal vez encuentren comida pero corren el riesgo de ser detectados por un gato al acecho.
Se ha observado repetidamente que en una situación como la descripta los ansiolíticos (fármacos que disminuyen los niveles de ansiedad) aumentan el tiempo que los animales pasan explorando el centro, expuestos a posibles peligros. Así, si bien no podemos afirmar que un ratón que pasa menos tiempo en el centro es ansioso, podemos predecir que una nueva droga que hace que un animal pase más tiempo en el centro posiblemente actuará como ansiolítico en los seres humanos.
Modelos como estos han resultado valiosos para probar grandes cantidades de compuestos e identificar algunos nuevos que han pasado a formar parte de la batería de fármacos disponibles para tratar distintas enfermedades.
Un modelo genético
Hay muchos grupos de investigación que estudian la asociación entre ciertas mutaciones genéticas y el autismo. Hasta la fecha no se ha demostrado que alguna particular cause la enfermedad, y por lo general hay consenso en que no se dará con el ‘gen del autismo’. Por ello muchos estudios han dirigido la atención a alteraciones de grandes fragmentos del genoma, o de genes que afectan el funcionamiento de muchos otros genes.

A la derecha, gráfico semejante al anterior correspondiente a un ratón al que se le inyectó una dosis de 15mg/kg del ansiolítico diazepam. Se puede observar una más intensa locomoción y mayor exploración del centro del ámbito.
Pero dado que cuando buscamos un modelo animal para una enfermedad no necesitamos enfrentarlo con la causa verdadera de esta en humanos, ni que exhiba todos los síntomas de ella, algunos investigadores se han centrado en estudiar en animales el efecto de mutaciones de genes específicos sobre los comportamientos relacionados con el autismo, y cuáles alteraciones del sistema nervioso central llevan al animal a comportarse de esa manera.
Uno de esos genes es el que contiene la información necesaria para que el organismo pueda producir la proteína eIF4E, un factor que regula la traducción de varios otros genes. Traducción es un complejo proceso por medio del cual la información genética, que está en el código de tres letras que conforman el ADN, es decodificada o traducida, para producir proteínas (véase Mariano Alló, ‘Epigenética: más allá de los genomas’, CIENCIA HOY, 123: 9-15, junio-julio de 2011). Ese gen había sido asociado con el autismo, por lo que un grupo de investigación de la Universidad McGill, en Montreal, decidió generar ratones a los que les faltara la proteína eIF4E y estudiar su comportamiento.
CRITERIOS QUE DEBE CUMPLIR UN BUEN MODELO ANIMAL DE UNA ENFERMEDAD PSIQUIÁTRICA
Existen dos componentes a tener en cuenta: la variable independiente
y la variable dependiente. La primera es la que modifica el investigador; es decir, lo que este hace al animal modelo para inducir una anormalidad o un comportamiento específico. La segunda constituye el efecto de la manipulación o el resultado que se mide.
Todo estudio científico debe cumplir con la condición de que el sistema experimental con el que se lo ejecuta sea confiable y reproducible. Así, un modelo animal utilizado por un grupo de investigadores en, por ejemplo, la Argentina debe reaccionar de manera similar si es empleado en Europa o los Estados Unidos. Y si el mismo animal modelo se estudia en las mismas condiciones en dos momentos distintos, los resultados obtenidos deben ser los mismos (más allá del margen de variabilidad individual de las observaciones).
El criterio principal que deben cumplir los modelos animales de enfermedades humanas es de permitir llegar a predicciones adecuadas.
El modelo animal tiene validez de predicción si el tratamiento probado en el animal muestra tener los mismos efectos en el humano, como sucede con las pruebas de ansiolíticos mencionadas en otro recuadro. Por lo menos, eso es lo más importante para la ciencia llamada traslativa (translational science), que traslada conclusiones del laboratorio a la práctica clínica. Pero en muchos casos esas conclusiones se obtienen tratando al cerebro como una caja negra, que responde a cierto fármaco de la manera esperada pero se ignora por qué. De ahí que, para muchos investigadores, por no revelar los
mecanismos biológicos de la enfermedad, esos modelos y las terapias
que permiten identificar tienen corta vida.
Hay otras características que hacen valioso un modelo animal. Entre ellas, que tenga validez etiológica, es decir, que la etiología o causa de la enfermedad sea la misma en el modelo animal y en el humano. Evaluar la validez etiológica –también llamada validez de construcción– implica conocer las hipótesis implícitas o explícitas que fundamentan la mencionada causa, por ejemplo, saber cómo genes específicos y sus productos pueden asociarse con determinados desórdenes. Así se han generado animales transgénicos cuyas mutaciones genéticas son homólogas a las humanas, como los de la Universidad McGill, mencionados en el texto con relación al factor eIF4E. Los estudios del comportamiento y farmacológicos de esos animales son importantes para identificar los cambios de los individuos (o fenotípicos) asociados con esas mutaciones y de esa manera comparar hipótesis acerca de la etiología de la enfermedad y explorar posibles tratamientos.
Por último, se puede apuntar a que el modelo animal muestre validez aparente. Eso significa que las alteraciones del animal (o sea, la variable dependiente) y el síntoma específico de la enfermedad humana sean parecidos. Detrás del requisito de validez aparente se encuentra el supuesto de que las alteraciones del animal y el síntoma específico de la enfermedad humana comparten las mismas bases fisiológicas, algo que no siempre es cierto y debe tenerse en consideración.
Comparados con ratones silvestres, los roedores en cuestión mostraron menor interés por congéneres desconocidos, pasaron más tiempo acicalándose, escondieron todas las bolitas que encontraron y vocalizaron más sonoramente. Es decir, mostraron un comportamiento relacionado con el autismo y se convirtieron en un modelo animal de autismo con validez de apariencia. Luego los científicos canadienses se preguntaron qué sucedía en el cerebro de un ratón privado del gen asociado con el factor eIF4E y concluyeron que funcionaba de manera algo distinta que el de un ratón normal: las neuronas del primero expresaban más cantidad de determinadas proteínas y eran más activas que las de los ratones salvajes.
LA HISTORIA DE UN MODELO DEL PARKINSONISMO
l mal de Parkinson fue descripto por primera vez en 1817 por el médico inglés James Parkinson (1755-1824), quien lo caracterizó
como una extraña parálisis con temblores. Los pacientes tenían dificultades para iniciar movimientos y temblaban cuando estaban quietos. Entre 1868 y 1881, el médico francés Jean-Martin Charcot (1825-1893) estudió la enfermedad e hizo una importante contribución a entenderla. Propuso con éxito, además, que se la llamara con el nombre de su descubridor. En torno a 1900, estudiando post mórtem cerebros de pacientes con la dolencia, el neurólogo estadounidense nacido en Berlín Frederic Lewy (1885-1950) advirtió que les faltaban las neuronas negras, que contienen grandes cantidades de melanina. Esas neuronas fabrican dopamina, uno de los neurotransmisores que permiten a las neuronas comunicarse entre ellas.
En 1968, Urban Ungerstedt, profesor del Instituto Carolino de Estocolmo, demostró que un derivado de la dopamina (6-hidroxi- dopamina) podía ser utilizado para lesionar específicamente ese grupo de neuronas de ratas. Aplicándoles ese compuesto se obtuvieron ratas que tenían averiadas las precisas neuronas que faltan en los pacientes con Parkinson. Distintos autores constataron luego que esos animales tienen dificultades para iniciar movimientos y exhiben síntomas similares a los observados en dichos pacientes.
Este modelo de la enfermedad de Parkinson tiene entonces cierta validez de construcción: si bien aún no sabemos por qué se mueren las neuronas en cuestión, sabemos, gracias al uso de modelos animales, que su falta provoca los síntomas de la dolencia. Constatamos que modelo y pacientes comparten ese rasgo. También la validez aparente del modelo es buena: si bien hasta donde sabemos nadie ha encontrado que las ratas padezcan de temblores, se ha constatado que tienen dificultades para iniciar movimientos y que sufren algunas otras alteraciones de comportamiento.
El modelo ha sido valioso para entender las consecuencias para distintas estructuras del cerebro de la pérdida de neuronas cuyo neurotransmisor primario es la dopamina (o neuronas dopaminérgicas). Además, ha servido para estudiar distintas drogas, luego probadas en ensayos clínicos con pacientes. Aunque hoy la enfermedad de Parkinson sigue sin cura, se ha avanzado considerablemente en el alivio de
sus síntomas, y eso se debe, por lo menos en parte, a los hallazgos científicos realizados utilizando modelos animales.
Hoy seguimos sin entender completamente el proceso por el que esas alteraciones del funcionamiento del cerebro afectan el comportamiento de los ratones, pero por lo menos creemos saber adónde mirar. Así podremos generar hipótesis acerca de lo que sucedería en los cerebros de los autistas, ponerlas a prueba y, en su momento, definir tratamientos.
Doctora en ciencias biológicas, FCEYN, UBA.
Jefa de trabajos prácticos, Departamento de Fisiología y Biología Molecular y Celular, FCEYN, UBA.
Investigadora adjunta del Conicet en el Instituto de Fisiología, Biología Molecular y Neurociencias, UBA-Conicet.










