Dispositivos que apuntan a paliar o evitar las consecuencias ambientales de la emisión de CO2 a la atmósfera por el uso de hidrocarburos fósiles.
Entre los desafíos que enfrentamos en materia de electricidad, no solo está cómo generarla causando bajo deterioro ambiental sino, también, cómo almacenarla y transportarla. Los dispositivos electroquímicos de conversión y almacenamiento de energía (que se suelen designar por la sigla DECAE) podrían desempeñar un papel clave en esto. Nos ocuparemos en esta nota de dos de los menos publicitados: la generación fotoelectroquímica de hidrógeno y la producción de metanol y otros compuestos a partir de dióxido de carbono (CO2).
Hidrógeno a partir de luz y agua
Ciertas fuentes renovables de energía producen electricidad en horas en que se la demanda poco: el sol brilla de día, que es también cuando suele soplar más el viento, pero necesitamos luz eléctrica de noche. Dado que la electricidad no consumida no puede almacenarse como tal (véase ‘Sistemas de almacenamiento de electricidad’ en este mismo número), se han ideado otras maneras de hacerlo, una de las cuales es transformar la energía eléctrica en energía química y acumularla en forma de hidrógeno. Un dispositivo que realiza esa conversión es el electrolizador, que a partir de agua y electricidad produce hidrógeno (H2) más oxigeno (O2), un proceso llamado hidrólisis o electrólisis. El hidrógeno puede almacenarse y en su momento reconvertirse en energía eléctrica, por ejemplo en una celda de combustible, o puede dársele otros usos energéticos, como impulsar motores de combustión interna.
Podemos concebir un combustible como un portador de energía (o vector de energía), cuya practicidad depende de cuánta energía contenga por unidad de peso o volumen, es decir, su densidad energética. El hidrógeno tomado como combustible tiene algunos inconvenientes. Si bien su densidad energética es alta por unidad de peso, dado que es un gas y que su temperatura de ebullición es extremadamente baja –cercana al cero absoluto–, esa densidad es muy reducida por unidad de volumen. Además, es difícil de almacenar porque resulta capaz de permear muchos materiales.
Las celdas de combustible son dispositivos que generan electricidad en forma directa y sin que haya combustión, a partir de combustibles como hidrógeno o metanol, más oxígeno que se puede tomar del aire.
El electrolizador o celda electrolítica se conoce desde hace tiempo. El primero del que se tienen noticias fue construido en 1800 por los ingleses William Nicholson (1753-1815), químico, y Anthony Carlisle (1768-1840), médico. Es un dispositivo que consiste en dos compartimentos o reservorios con agua (u otro líquido, genéricamente llamado electrolito) separados por un tabique poroso o una membrana que permite el paso de iones (partículas cargadas) y evita la mezcla de los productos (H2 y O2). En cada compartimento hay una barra llamada electrodo. La circulación de una corriente eléctrica descompone el agua en hidrógeno y oxígeno. En la actualidad, el hidrógeno se genera para diversos usos, entre los cuales el almacenamiento de energía es minoritario, y proviene mayoritariamente del reformado de gas, dado su bajo costo. La electrólisis es una opción empleada para operaciones de pequeña escala o cuando conviene generarlo en el lugar de utilización. La mejora de la hidrólisis sigue siendo tema de investigación.
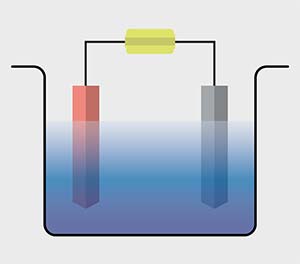
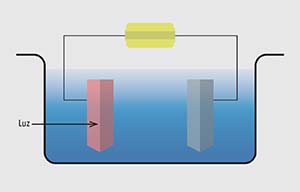
En 1972 Akira Fujishima, que preparaba su tesis doctoral en la Universidad de Tokio dirigido por Kenichi Honda, encontró que si en uno de los electrodos se empleaba un material semiconductor, se lograba generar hidrógeno y oxígeno sin electricidad, solo con luz y agua, lo que se llama fotólisis de agua. Este descubrimiento abrió la posibilidad de convertir energía lumínica directamente en un combustible. En la mayoría de los semiconductores, sin embargo, la luz necesaria para que ello suceda es la ultravioleta, lo cual tiene el inconveniente de que el agua la absorbe y se convierte en una pantalla que baja la eficiencia del proceso. Con el fin de sortear esa limitación se procuró encontrar semiconductores que respondieran a la luz visible, pero en ese caso resulta necesario agregar electricidad. Esta forma de generar H2 y O2 con luz y electricidad (o fotoelectrólisis de H2 y O2 a partir de agua) se conoce en inglés como water splitting.
Hoy hay dos tipos de diseño aplicable a los dispositivos de fotoelectrólisis. Uno tiene un ánodo fotoactivo semiconductor que genera O2 y un cátodo metálico que produce H2; de este tipo es el de Fujishima y Honda. El otro combina semiconductores fotoactivos en ambos electrodos para generar hidrógeno y oxígeno en los dos; se lo denomina diodo tándem y tiene la ventaja de permitir un mayor aprovechamiento del espectro solar, pues absorbe más luz visible.
La producción de hidrógeno con luz y agua, sin aplicar electricidad, es sin duda un desafío sobre el que hay mucha investigación en curso, mientras que en materia de fotoelectrólisis se han realizado grandes avances en los últimos años con el advenimiento de técnicas para actuar sobre partículas del tamaño de nanómetros (o nanotecnología).
Obtención de combustibles de la atmósfera
El dióxido de carbono o CO2 es un gas que resulta de la combustión de cualquier compuesto orgánico en presencia de aire. Por eso, usar combustibles fósiles lo emite a la atmósfera, algo que la humanidad hizo y sigue haciendo en cantidades crecientes.
Ante este estado de cosas, dada no solo la relativa abundancia de CO2 sino, también, la conveniencia de disminuir el que hoy tiene la atmósfera (o por lo menos no aumentarlo) surgió la idea de reconvertir ese CO2 atmosférico en un compuesto con valor práctico, que pueda ser usado como combustible o sirva de punto de partida para producir otros compuestos. Producto de esa conversión se pueden obtener, entre otros, monóxido de carbono (CO), acido fórmico (HCO2H), metanol (CH3OH) y metano (CH4). La amplia variedad posible de compuestos abre oportunidades para elegir el más adecuado para el uso que se desee. Si bien la fuente principal que se tuvo en mente fue el CO2 atmosférico, también es posible y conveniente aplicar el procedimiento en puntos de alta generación de CO2, como las industrias del cemento, el hierro o el aluminio. La conversión puede realizarse de forma química o electroquímica.
En términos técnicos, esas conversiones se llaman reacciones de reducción-oxidación (o redox). Son las que tienen lugar cuando las moléculas o los átomos del compuesto original ganan o pierden electrones al pasar a integrar el compuesto resultante: reducción implica ganancia de electrones; oxidación, pérdida de ellos.
Entre los productos nombrados, consecuencia de reacciones de reducción de CO2, el metanol tiene amplio interés como insumo de la industria química, pues se emplea para fabricar formaldehído, metil terbutil éter (MTBE) y ácido acético. El formaldehído, a su vez, es utilizado para la producción de polímeros y resinas. En la actualidad, el metanol se obtiene principalmente de combustibles fósiles a partir de la reacción de gas de síntesis (syngas), el cual es una mezcla de dos partes de H2 y una parte de CO. La reacción que produce metanol a partir de ese gas tiene lugar con catalizadores de cobre (Cu) y óxido de cinc (ZnO).
El químico de origen húngaro George A Olah, profesor de la Universidad del Sur de California y premio Nobel de la disciplina en 1994, propugnó el uso del metanol como vector de energía. Sugirió que en el futuro una economía del metanol podría reemplazar a la actual economía de hidrocarburos fósiles. Si bien su densidad energética es mucho menor que la del hidrógeno, es más sencillo de transportar y almacenar por mantenerse líquido a temperatura ambiente. Comparado con otros combustibles líquidos, su mayor octanaje y mejor coeficiente de compresión lo hace competitivo. A su vez, del metanol se obtiene dimetil éter (DME), un compuesto que puede emplearse en sustitución del gasoil y, como es gaseoso a temperatura ambiente, puede también reemplazar al gas licuado de petróleo y al gas natural comprimido.
Tanto el metanol como el DME, por ser sustancias y no mezclas como los otros combustibles líquidos, tienen una combustión mucho más limpia: no emiten óxidos de azufre o nitrógeno, los cuales también contribuyen a la contaminación ambiental. Otro motivo para elegir el metanol como producto de la reducción de CO2 es la posibilidad de utilizarlo en las citadas celdas de combustible, para obtener energía eléctrica sin combustión. Al mismo tiempo, por un proceso llamado metanol a olefinas, de metanol y dimetil éter se obtienen etileno y propileno, y a partir de estos un sinnúmero de otros compuestos que cubren prácticamente todos los actuales derivados del petróleo, comenzando por polietileno y polipropileno.
Como se advierte en la fórmula del metanol (CH3OH), este se compone de hidrógeno, además del carbono y el oxígeno del CO2. Para evitar que el proceso, que tiene el propósito de quitar CO2 de la atmósfera, no esté causando que este se agregue a ella por otro lado, es necesario disponer de H2 obtenido de fuentes que no generen CO2. En otras palabras, es necesario usar electricidad producida por energías que no emitan CO2.
En 2012 la empresa islandesa Carbon Recycling International abrió una planta de escala industrial de reducción de CO2 a metanol, a la que puso el nombre del citado George Olah. Puede producir unos 5 millones de litros anuales de metanol usando H2 obtenido por electrólisis con electricidad de la red pública, que proviene por completo de fuentes renovables: 70% energía hidroeléctrica y 30% geotérmica.

Reducir el CO2 atmosférico por un procedimiento electroquímico tiene la ventaja de que, en términos generales, se realiza a temperatura ambiente y en medio acuoso, pero con la dificultad de la baja solubilidad del CO2 en agua. Por ello se ha buscado utilizar solventes orgánicos, que no son óptimos para dispositivos de gran escala. Se ha estudiado una gran variedad de materiales para construir los electrodos con los que llevar a cabo electrorreducción del CO2, ya que el producto obtenido depende del material de los electrodos y de la composición del líquido en que están sumergidos o electrolito, pero no todos los materiales analizados se adaptan a procesos llevados a la escala industrial.
El metanol es posiblemente el producto más deseado, pero el más difícil de obtener. Ciertos electrodos, como los de estaño (Sn), plomo (Pb) o indio (In), son adecuados para producir con eficiencia ácido fórmico, del que se puede obtener metanol. Con electrodos de oro (Au) se obtiene principalmente monóxido de carbono (CO). En todos los casos se forma también H2, que es un subproducto deseable. En 2010 la empresa Noruega DNV construyó una planta piloto móvil para electrorreducir CO2 a ácido fórmico empleando electricidad generada por paneles solares fotovoltaicos.
La reducción de CO2 atmosférico proporciona un camino para generar productos que hoy se obtienen de los combustibles fósiles. Si bien el uso posterior de esos productos puede enviar CO2 a la atmósfera, no se produce un incremento neto del gas en ella, porque el emitido había provenido inicialmente de allí. Es decir, se genera un ciclo continuo de circulación del CO2, que repetidamente se toma de la atmósfera y se libera a ella.
Comentarios finales
En la actualidad las dos tecnologías descriptas se encuentran en una etapa de laboratorio o de planta piloto. Con ellas se puede apuntar a construir instalaciones de gran escala, capaces de generar grandes cantidades de H2 y otros productos a partir de CO2, o de pequeña escala, con pequeños dispositivos que satisfagan en forma aislada los requerimientos de una casa, un edificio o una comunidad reducida. El requisito para que sean parte del esfuerzo de reducir las emisiones de gases de efecto invernadero es que utilicen electricidad que no provenga de combustibles fósiles, sino que sea generada con energía eólica, solar, hidráulica o geotérmica. Sus perspectivas en la Argentina, pues, están atadas a las de estas formas de generación eléctrica, que están débilmente representadas en la matriz energética actual. A su vez, dichas formas dependen en mucha medida de la evolución de las tecnologías y los precios de los combustibles fósiles, en especial el gas natural.
Sea esto como fuere, las dos opciones tratadas de almacenar y convertir energía todavía requieren un amplio esfuerzo de investigación y desarrollo, que es aconsejable emprender con una mirada de largo plazo, para que puedan estar en mejores condiciones de competir con tecnologías bien establecidas y de bajo costo como las aplicadas para aprovechar el petróleo.
El autor agradece a María Dolores Pérez sus comentarios sobre el manuscrito.











