Un biorreactor es un dispositivo en el que tienen lugar reacciones bioquímicas controladas, puestas en marcha con diferentes propósitos, entre ellos la producción de alimentos o la síntesis de proteínas para uso medicinal o industrial. Varias de dichas proteínas pueden ser producidas en plantas transgénicas, método que presenta numerosas ventajas, pues son las mismas células vegetales las que lleven adelante las reacciones necesarias para producir las proteínas, a las que se da el nombre de recombinantes.
La creciente demanda de compuestos con acción terapéutica para uso médico y veterinario impulsó durante los últimos años el desarrollo de nuevas tecnologías para su producción. A partir de la década de 1980, la ingeniería genética –que engloba métodos y herramientas para aislar, modificar y transferir material genético– permitió elaborar el primer producto aprobado para uso clínico en humanos derivado de la manipulación de ADN: insulina obtenida de la bacteria Escherichia coli. Así, proteínas que inicialmente se extraían de una fuente que los genera de modo natural (la insulina provenía de páncreas de cerdos), hoy se pueden producir en sistemas (llamados heterólogos) distintos de tal fuente, como bacterias, levaduras, cultivo de células, o animales y plantas transgénicos. Las proteínas obtenidas de esa manera se llaman proteínas recombinantes.
Las plantas presentan características muy atractivas para ser utilizadas en la producción de proteínas recombinantes, entre otras, fácil cultivo, bajo costo, aumento fácil de la escala de producción por extensión de la superficie cultivada si crece la demanda. Además, la posibilidad de almacenar establemente las proteínas recombinantes en semillas y tubérculos facilita su transporte, almacenamiento y distribución. En 1983 se obtuvo la primera planta transgénica a partir del tabaco y quedaron establecidas las bases para la producción de cultivos genéticamente modificados de importancia económica.
¿Cómo se obtiene una planta transgénica?
Para generar una planta transgénica (u organismo vegetal genéticamente modificado) se necesita disponer tanto de un método adecuado para introducir ADN ajeno en las células vegetales, como de un procedimiento o protocolo para poder regenerar una planta completa a partir de las pocas células que incorporaron exitosamente ese ADN.
En la actualidad existen múltiples maneras de introducir ADN en células vegetales, basadas en principios químicos, físicos y biológicos. La elección de una técnica particular depende de la especie que se desea modificar genéticamente. El propósito de todas es que el gen ajeno o transgén ingrese en las células de la planta en cuestión y se integre establemente a su genoma.
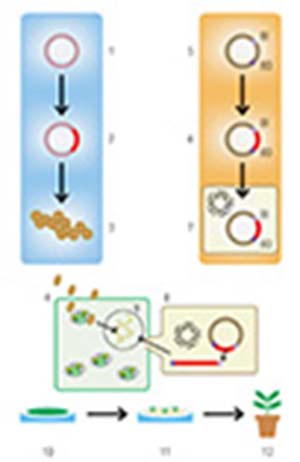
La primera técnica desarrollada –y aún la de uso más frecuente– recurrió a una bacteria del suelo, Agrobacterium tumefaciens, que infecta naturalmente plantas y les transfiere un fragmento específico de su material genético. Para poder valerse de ella, los investigadores introdujeron algunas modificaciones genéticas en dicha bacteria, con el fin de eliminar ciertos efectos indeseados que le provocaría a la planta de interés, y lograr que transfiera a esta los fragmentos de ADN con los que se quiere transformarla genéticamente. Pero para que pueda hacer lo segundo debe comenzarse por introducir esos genes en la bacteria, la que luego los transferirá a las células vegetales.
Otro método utilizado con frecuencia para introducir material genético en células vegetales es la biobalística. Consiste en depositar moléculas de ADN sobre micropartículas de oro o tungsteno, las que luego son disparadas mediante un gas a presión contra tejidos vegetales. Por la velocidad con que llegan, logran atravesar la pared de las células con su carga de ADN, que puede así incorporarse al genoma de la planta. Ambos caminos se muestran esquemáticamente en la figura 1.
Cualquiera sea la vía elegida, se comienza en el laboratorio introduciendo en células de la planta que se desea transformar genéticamente el fragmento de ADN que contiene los genes de interés. Ello se hace en una porción (denominada explanto) de hoja, tallo o raíz. A partir de las pocas células transformadas del explanto luego es necesario regenerar una planta transgénica completa, lo que se realiza en condiciones de esterilidad colocando los explantos en un medio de cultivo dotado de hormonas y otros compuestos reguladores del crecimiento vegetal.
El objetivo de esa etapa es inducir cambios fisiológicos para que las células que incorporaron establemente el ADN exógeno sobrevivan, se multipliquen y se diferencien hasta generar todos los tipos celulares de la planta. A veces ese proceso comienza por la formación de una masa de células indiferenciadas denominada callo, que en condiciones adecuadas es capaz de generar embriones somáticos (así llamados porque son similares a un embrión pero que no se originaron por unión de gametos). Otras veces las células transformadas forman directamente órganos vegetales (como raíces o tallos) sin pasar por la etapa del callo. Una vez que la planta desarrolló raíces y tallo se la pasa a tierra para que continúe su crecimiento.

Debido a que no todas las células del explanto resultan transformadas, las que no lo fueron –que son mucho más abundantes– deben ser eliminadas, para no regenerar plantas no transgénicas. Para hacerlo, se incorporan a las células del explanto, junto con los genes de interés, otros que confieren resistencia a antibióticos, herbicidas u otras drogas que se incluyen en el medio de cultivo. De esa manera, solo las células transformadas sobreviven y pueden regenerar una planta completa. La figura 2 ilustra el proceso.
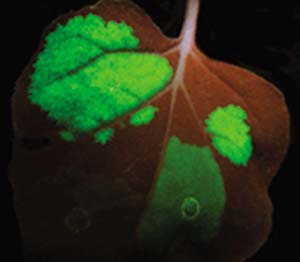
Las proteínas recombinantes que se procura obtener también pueden lograrse de forma transitoria, sin la necesidad de producir plantas transgénicas. Entre los métodos utilizados, denominados no integrativos, está la agroinfiltración, que consiste en infiltrar el espacio intercelular de un tejido del vegetal (de una hoja, por ejemplo) con una suspensión que contenga la bacteria A. tumefaciens genéticamente modificada. Los genes de interés llegarán al interior de las células de la planta por la acción natural de la bacteria y al cabo de unos días se podrá constatar su expresión por diversos métodos cuya elección depende de la proteína recombinante, por ejemplo, si esta es fluorescente, iluminar la zona infiltrada con luz ultravioleta, según se puede apreciar en la figura 3.
Otros métodos recurren a virus o a micropartículas. Todos permiten una rápida producción de proteínas recombinantes pero, por no generar una planta transgénica completa, pierden con el tiempo su capacidad de hacerlo y es necesario repetir el procedimiento en forma regular. La elección de un método estable o uno transitorio depende, entre otros factores, del tipo y la cantidad de la proteína recombinante a producir.
¿Por qué usar plantas?
El uso de plantas como biorreactores ha permitido producir plásticos biodegradables, proteínas recombinantes y fármacos, entre otras moléculas de interés. Proinsulina, citoquinas, factores de crecimiento, antígenos usados como vacunas contra la hepatitis B y cepas enterohemorrágicas de Escherichia coli son algunos ejemplos de proteínas recombinantes con acción terapéutica. Existen también desarrollos cuyo objetivo es producir en plantas comestibles antígenos para vacunas orales de uso humano o veterinario, lo que facilitaría obtener la vacuna y disminuiría notablemente sus costos de producción.
En 2012, la agencia Food and Drug Administration de los Estados Unidos, que regula los medicamentos en ese país, aprobó por primera vez la comercialización de una proteína recombinante de uso terapéutico producida en plantas, que se emplea para tratar la enfermedad de Gaucher, causada por una deficiencia hereditaria en la enzima glucocerebrosidasa. La droga aprobada contiene una variante de esa enzima producida en células de zanahoria.
Existen muchas herramientas moleculares que permiten optimizar la producción de proteínas en plantas, entre ellas, dirigir su localización a distintos compartimentos intracelulares para aumentar su estabilidad o facilitar su purificación, o promover su acumulación en distintos órganos de la planta, como hojas, tubérculos, frutos, semillas o raíces. A modo de ejemplo, se ha demostrado que es posible acumular proteínas recombinantes en el espacio intercelular que, en consecuencia, sean secretadas por sus raíces. También se ha encontrado la manera, en sistemas hidropónicos, de realizar la purificación de esas proteínas en el medio que rodea las raíces. La elección de las herramientas más adecuadas depende de las características de la molécula a producir, de la cantidad y calidad necesarias y de la especie vegetal utilizada. Cada proteína recombinante plantea un nuevo desafío y conduce al examen de métodos alternativos hasta encontrar el óptimo.
¿Qué se hace en la Argentina?
La producción de vacunas de uso veterinario es una de las aplicaciones del uso de plantas como biorreactores que más interés ha despertado en la comunidad científica y tecnológica local. Se puede encarar utilizando instalaciones y capacidades bien establecidas en un país en que la agricultura es una de las actividades de mayor desarrollo. Varios grupos de investigación están llevando a cabo proyectos en organismos públicos y privados en procura de obtener diversas proteínas recombinantes a partir de plantas, como se desprende de la tabla.
Algunos de esos intentos se vieron limitados al no alcanzarse los niveles de producción necesarios para pasar a una escala comercial. En ese contexto, se buscó superar determinadas restricciones asociadas con la introducción de transgenes en el ADN nuclear. En su lugar se eligió incorporarlos al genoma de los cloroplastos, unas estructuras propias de las células de plantas y algas que alojan la maquinaria de la fotosíntesis. Una de esas células puede contener hasta cien cloroplastos, cada uno de los cuales tiene múltiples copias de su genoma. En 1990 se demostró por primera vez la posibilidad de introducir genes en el genoma de cloroplastos de tabaco: se consiguieron plantas transgénicas denominadas transplastómicas. A partir de entonces, se ha logrado obtener numerosas proteínas heterólogas modificando genéticamente cloroplastos de plantas. Una ventaja importante de este método es que las mencionadas plantas transgénicas son ambientalmente más seguras, pues los genes de los cloroplastos no forman parte del polen de gran parte de las especies de interés agronómico, lo que dificulta su transferencia a plantas silvestres emparentadas.
Investigadores del Instituto de Investigaciones en Ingeniería Genética y Biología Molecular Héctor Torres, del Conicet, en el que se desempeñan los autores, modifican genéticamente el genoma de cloroplastos de plantas de tabaco y de papa. A partir de 2004, el procedimiento fue empleado con éxito para producir distintas proteínas, entre ellas varias que podrían en el futuro ser usadas para desarrollar vacunas de interés veterinario, como son el antígeno P1 para vacunar contra la fiebre aftosa y la proteína VP8 contra el rotavirus bovino. Otras proteínas obtenidas de esas plantas incluyeron factores de crecimiento, anticuerpos de camélidos, una proteína antigénica del herpevirus humano, y proteínas de acción antifúngica y antibacteriana para crear en el futuro cultivos resistentes a patógenos de importancia agronómica. Estos resultados ejemplifican el potencial que la transformación del genoma del cloroplasto tiene para obtener proteínas recombinantes de plantas.
¿Cómo se regulan los organismos genéticamente modificados?
Igual que todos los medicamentos, las proteínas heterólogas de interés médico o veterinario, aunque sean producidas mediante procedimientos de ingeniería genética aplicada a plantas, deben seguir estrictas normas de bioseguridad. Las plantas transgénicas de las cuales se extraen esas moléculas también se cultivan y mantienen siguiendo normas rigurosas.
El principio sobre el que se apoya la regulación de plantas transgénicas, válido en el ámbito nacional y promovido por las múltiples agencias internacionales que se ocupan de estos temas, es que los organismos genéticamente modificados deben ser por lo menos tan seguros como los no transgénicos de los que provienen. Las entidades regulatorias, en consecuencia, se basan en la comparación de las cualidades de plantas transgénicas con las de sus contrapartes no transgénicas. Analizan aspectos como seguridad para la alimentación humana y animal, alergenicidad, actividad biológica, aptitudes nutricionales, composición química y repercusiones ambientales, entre otros. Además, en el caso de las plantas transgénicas utilizadas como biorreactores, se tienen en cuenta aspectos adicionales de bioseguridad.
Desde 1991 la Argentina posee un marco regulatorio para evaluar aspectos de bioseguridad de esos organismos. Su objetivo es que sean seguros para los agroecosistemas e inocuos para el consumo humano y animal. Se basa en principios científicos y regula el desarrollo del producto caso por caso, desde las primeras liberaciones experimentales, y se anticipa a cualquier efecto no esperado que pudiera acontecer. La entidad gubernamental responsable es el Ministerio de Agricultura, Ganadería y Pesca, que se basa en los informes técnicos que elaboran tres direcciones y sus comisiones asesoras. La Dirección de Biotecnología y la Comisión Nacional Asesora de Biotecnología Agropecuaria (Conabia) evalúan los posibles riesgos de un cultivo transgénico para los agroecosistemas. El Servicio Nacional de Sanidad y Calidad Agroalimentaria (Senasa) y su Comité Técnico Asesor sobre uso de organismos genéticamente modificados evalúan los riesgos potenciales para la salud animal y la humana derivados de consumir un alimento transgénico o sus subproductos. Y la Dirección Nacional de Mercados Agrícolas determina la conveniencia de comercializar material genéticamente modificado para evitar potenciales consecuencias negativas para las exportaciones.
Si un organismo genéticamente modificado se considera seguro para el agroecosistema, inocuo para el consumo tanto humano como animal y no perjudicial para la economía nacional, queda en condiciones de que los órganos competentes del mencionado ministerio autoricen su cultivo, comercialización y consumo. Esos son los pasos que han seguido las aprobaciones de cultivos transgénicos como soja, maíz y algodón con nuevas características, como la resistencia a insectos y la tolerancia a herbicidas diversos. Por esta vía recibieron reciente aprobación para salir al mercado una papa resistente al virus PVY (potato virus Y) y una soja que tolera la sequía, primeros productos de un trabajo en cooperación de investigadores del Conicet y empresas locales. Las plantas transgénicas desarrolladas para producir proteínas de interés farmacéutico o industrial deben evaluarse siguiendo las mismas normas.











