Los jugos de frutas que se encuentran en las estanterías de los supermercados se suelen tratar con pectinasas, enzimas que plantean ciertos problemas biotecnológicos. Algunas de ellas, además, producen alcohol metílico, que contamina el zumo y puede ser dañino para la salud.
Los jugos de frutas prensadas son viscosos y turbios; para aclararlos y tornarlos apetecibles se los trata con enzimas, proceso que libera alcohol metílico. Por ello, quien los consume regularmente podría estar ingiriendo un producto tóxico durante gran parte de su vida
Las enzimas son catalizadores biológicos, es decir, proteínas que tienen la capacidad de acelerar ciertas reacciones químicas. En los últimos años, su utilización como elementos auxiliares del procesamiento de alimentos ha adquirido gran relevancia. (Tabla I)
La producción de una enzima por los métodos de la biotecnología clásica incluye dos etapas principales: la de férmentación, en la que se multiplica el microorganismo productor de la enzima, y la de recuperación y purificación, en la que se aisla la enzima y se la lleva al grado de pureza adecuado para su uso. En la nueva biotecnología, nacida gracias a la ingeniería genética, existe una tercera etapa, la construción del ente recombinante, que producirá la enzima deseada (véase “Proteínas a pedido”, Ciencia Hoy 29:31 – 42).
Tabla 1- Enzimas usadas en los procesos de la industria agroalimentaria
ENZIMAS USADAS EN LOS PROCESOS DE LA INDUSTRIA AGROALIMENTARIA
PRODUCTO ENZIMAS
Cerveza Alfa-amilasa, Beta-glucanasa, Proteasa (Bacillus), Papaína, Amiloglucosidasa, Pululanasa, Xilanasa
Leche Proteasa ácida animal, Proteasa ácida fúngica, Lactasa, Lipasa, Lisozima
Pan Alfa-amilasa, Xilanasa, Proteasa (fúngica), Proteasa (Bacillus), Fosfolipasas A y D, Lipooxígenasa
Fruta y Hortalizas Pectinasas, Arabinasa, Hemicelulasa
Almidón y Azúcar Alfa-amilasa, Beta-amilasa, Glucoamilasa, Isomerasa, Pululanasa, Isoamilasa, Oligoamilasa, Cicloglucosiltranferasa, Xilanasa
Un viejo axioma biotecnológico sostiene que nunca se debe purificar un compuesto más de lo necesario, pues aumentaría el costo del producto final, con la consiguiente desventaja en el mercado. Por ello, se requiere diseñar un procedimiento que asegure una pureza de las enzimas adecuada para su uso. En general, las utilizadas en la industria alimentaria no necesitan una purificación extrema, comparada, por ejempIo, con la requerida por algunas de uso terapéutico.
El grupo de investigación de los autores se ocupa de purificar proteínas, en particular enzimas, tanto para empIeo alimentario como para otros fines. En lo que sigue se considerará un conjunto de enzimas empIeadas en el procesamiento de alimentos vegetales, denominadas genéricamente pectinasas, que digieren la pectina, substancia presente en las paredes de las células vegetales y en la lámina media (o estructura que une las células para formar tejidos).
Porque así lo prefiere el consumidor, algunos jugos de frutas, como los de manzana y pera, deben tener aspecto cristaIino, lo cual hace necesario aclararlos, ya que el producto obtenido por prensado es viscoso -debido a la pectina disuelta- y persistentemente turbio -por los fragmentos de paredes celulares en suspensión-. Cuando se agregan pectinasas, la viscosidad disminuye y las partículas pueden eliminarse fácilmente, dejándolas sedimentar, centrifugando el líquido o filtrándolo. Por otra parte, el tratamiento aumenta el rendimiento en jugo de la fruta prensada, pues al apretarla se forma una masa semigelificada que carece de microcanales por los que pueda fluir el zumo. Las pectinasas destruyen el gel y dan lugar a que el liquido corra libremente, mientras los sólidos remanentes, insolubles, forman una pulpa que es fácil de prensar.
Los jugos de naranja o pomelo, contrariamente a los anteriores, deben llegar turbios al consumidor -¡oh tempora, oh mores!-, por lo que se usan las mismas enzimas para causar un efecto contrario al aclaramiento. Con el tiempo, las pectinas de alto peso molecular tienden a precipitar, a causa del calcio presente en el jugo; si se tratan de manera controlada con pectinasas, se reduce su peso molecular, no precipitan y la turbidez del jugo se estabiliza. De esta manera, se evita que en los estantes del supermercado aparezcan botellas llenas hasta la mitad con sedimento y el resto con un líquido transparente.
En los extractos comerciales de pectinasas usados para la fabricación de jugos de fruta coexisten tres enzimas: la pectinliasa, la poligalacturonasa y la pectinesterasa. La pectina es un polisacárido constituido principalmente por la unión de muchas moléculas de ácido galacturónico (el derivado ácido de la galactosa) parcialmente metoxilado (es decir, con los grupos H del ácido reemplazados por CH3, denominados metilas). La figura 1 muestra los puntos de ataque (la unión química que se rompe) de las diversas pectinasas. La pectinliasa actúa sobre la pectina; las pectinesterasas remueven los grupos CH3, por lo que se las denomina enzimas demetoxilantes, y la poligalacturonasa actúa solamente si la pectina ha sido previamente desprovista de los metilos por acción de las pectinesterasas.
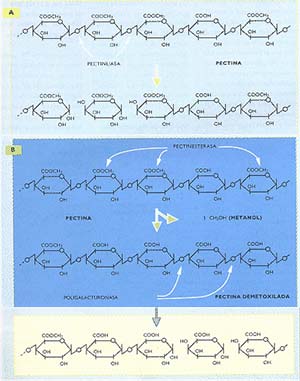
Como se observa en esa figura, la demetoxilación de la pectina por la pectinesterasa libera metanol (o alcohol metilico), que queda en el jugo; se trata de un caso típico de generación de una substancia tóxica como parte del procesamiento de un alimento. Por lo general, los jugos se concentran, por calentamiento o por ultrafiltración, en el lugar de producción, para reducir el flete; luego se los diluye y envasa cerca de los sitios de venta. Aquellos que fueron sometidos a este proceso de concentración y dilución suelen llevar un rótulo que así lo indica y tienen la ventaja de haber perdido casi totalmente el metanol, junto con algunos compuestos aromáticos, debido al concentrado. Pero también se venden jugos que no siguieron los pasos anteriores, distribuidos directamente al público luego de ser prensada la fruta y aclarado el zumo: son los que conservan el metanol y, por ende, expondrían a los grandes bebedores de zumo a riesgos de los que aún se sabe poco.
Los autores de esta nota han realizado en laboratorio dosificaciones de metano de varios jugos de manzana que se distribuyen comercialmente. Encontraron hasta 100mg por litro en los que no fueron concentrados y, si bien no se trata de una cantidad que pueda provocar intoxicación aguda, ni ocasionar problemas de toxicidad subaguda, podría representar un peligro para quienes consumen mucho de esos productos, ya que no se conoce gran cosa sobre la toxicidad subcrónica del metanol. Aclaremos que el vino contiene cantidades superiores de metanol (hasta 300-4OOmg/l), pero coexiste con concentraciones mucho, más altas de etanol, su antídoto biológico.
Los investigadores japoneses S. Ishii y T. Yokotsuka demostraron que, utilizando pectinliasa purificada -que no necesita de la acción previa de la pectinesterasa, responsable de la liberación de metanol, para degradar a la pectina-, se puede aclarar jugo de manzana sin producción simultánea de metanol. Pero el método requiere varias etapas cromatográficas, lo que descarta su utilización práctica por razones económicas. El desafio que se plantearon los autores del presente trabajo fue eliminar la pectinesterasa de un preparado comercial de pectinasas por algún método de purificaclón que pudiera ser adoptado por la industria, pues, a medida que las reglamentaciones alimentarias se vayan haciendo más estrictas, las industrias deberán adoptar procedimientos que les permitan elaborar productos mas saludables.
Los métodos cromatográficos de purificación de proteínas se pueden clasificar según cómo aprovechen alguna propiedad fisicoquímica de las moléculas en estudio (véase “¿Qué es la cromatografía?”). Así, la cromatografía de exclusión molecular separa las moléculas por su tamaño; la de intercambio iónico diferencia la carga eléctrica de ellas, en la de interacción hidrofóbica quedan retenidas en la columna aquellas proteínas que, por las características de los aminoácidos de su superficie, se unen a la matriz excluyendo el agua (son hidrófobas), y la de afinidad se basa en interacciones específicas entre la molécula a purificar y la matriz de la columna.
Debido a que el tamaño, la carga eléctrica y la hidrofobicidad de la pectinesterasa son semejantes a los de otras pectinasas presentes en la mezcla, optamos por la cromatografía de afinidad, técnica que, cuando se emplea para inmovilizar un anticuerpo con el propósito de purificar un antígeno (o viceversa), es muy cara y, por lo tanto, sólo aplicable a la purificación industrial de proteínas de gran valor comercial. Pero hay una cromatografía de afinidad, llamada pseudobioespecíflca, en la que, para purificar proteínas, se inmovilizan en la matriz colorantes o iones, substancias que, debido a su estructura, simulan algún compuesto natural al que la proteína se une, pues tiene afinidad por él. Aunque se trata de un procedimiento de menor selectividad, es también mucho más barato.
Los autores trabajaron con cromatografía de iones metálicos inmovilizados (IMAC, de Immobilized Metal ion Affinity Chromatography), que cumple con dos requisitos fundamentales: costo relativamente bajo y posibilidad de ejecutar el proceso en escala industrial. Se basa en la interacción de un metal con ciertos grupos funcionales de una proteína, sobre todo el aminoácido histidina (véase “La estructura de las proteínas”, Ciencia Hoy 29:32-34). En la figura 2 se explica cómo se produce dicha interacción: un metal de transición -por ejemplo, cobre (Cu)-, se agrega a una matriz de agarosa (un polisacárido insoluble), que contiene el grupo quelante iminodiacético. El grupo quelante simplemente retiene el Cu y forma un complejo estable.
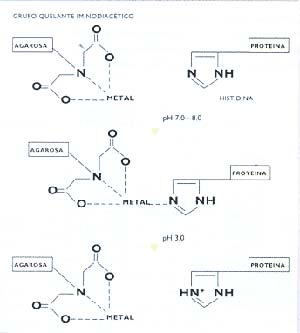
La matriz se coloca en un tubo de vidrio o plástico y se hace pasar a través de ella la solución de proteínas: sólo quedarán retenidas aquellas que tengan histidina en la superficie, las que podran interaccionar con el metal; el resto pasa (o eIuye, en el lenguaje del laboratorio) sin interaccionar. Las proteínas unidas al metal se separan de este por la simple disminución del pH. Al producirse tal disminución, o aumentar la acidez del medio, (que es decir lo mismo), las histidinas toman una carga eléctrica positiva -un protón (H+)- de este (en jerga, se protonan), con lo que pierden su capacidad de interacción con el metal inmovilizado en la matriz cromatográfica.
Cuando los autores pasaron una solución de un preparado comercial de pectinasas extraídas de hongos por una columna de IMAC, obtuvieron dos fracciones (Fig. 3), una que, eluía de la columna sin interaccionar (I) y otra, que sólo eluía al disminuir el pH al valor 3,0 (II). Después, determinaron que la pectinliasa estaba en I, mientras que en II se encontraban la pectinesterasa y la poligalacturonasa. En otras palabras, se había encontrado un método factible de ser utilizado en la industria para fraccionar una mezcla de pectinasas de manera que quedara separada la pectinliasa de un preparado comercial de las otras pectinasas.
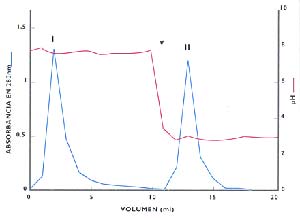
Cuando se procedió a clarificar jugo de manzana con cada una de las fracciones y se hizo una dosificación de metanol en los zumos aclarados, se halló, como era previsible, que el alcohol estaba ausente cuando se usaba la fracción I, que no contenía pectinesterasa. En cambio, se había producido metanol, debido a la acción conjunta de la pectinesterasa y la poligalacturonasa al utilizar la fracción II. Una ventaja de esta forma de fraccionamiento es que la pectinesterasa, separada de la mezcla y presente en la fracción II, no se desecha y puede ser utilizada para aclarar jugos que serán concentrados o -previa separación de la pectinesterasa de la poligalacturonasa- para otros fines, como la producción de pectina demetoxilada (ácido péctico), que se usa como espesante en la industria de las mermeladas.
Como segundo paso, se buscó el procedimiento óptimo de separación en cuanto al solvente cromatográfico, el metal inmovilizado, el flujo cromatográfico, la concentración de la muestra y la fuerza iónica necesaria para retener toda la pectinesterasa en la columna. En la tabla 2 se muestran los resultados obtenidos con distintos metales inmovilizados: cobre, níquel (Ni) y zinc (Zn). Sobre la base de consideraciones de rendimiento y estabilidad del metal inmovilizado en la matriz cromatográfica, se concluyó que el cobre permitía una mejor separación.
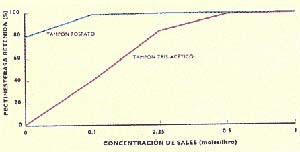
La figura 4 muestra la influencia de la fuerza iónica, producida por concentración de sales -por ejemplo, de cloruro de sodio (NaCl)-, y del tampón cromotográfico, o líquido de elución, sobre el fraccionamiento por IMAC. Se halló que la pectinliasa no interacciona con la matriz cromatográfica en ninguna condición de fuerza iónica, tanto con tampón Tris (nombre común del Tris-hidroximetil-aminometano) como con tampón fosfato. Por el contrario, la pectinesterasa es adsorbida por la matriz cromatográfica, con mayor interacción al aumentar la fuerza iónica del tampón. Aunque este resultado es cualitativamente similar para las dos soluciones tampón ensayadas, se encontró que el uso de fosfato para la adsorción y acetato para la elución mejora el fraccionamiento cromatográfico con respecto al tampón Tris, ya que se requiere menor concentración de NaCl para obtener adsorción total de la pectinesterasa, lo cual disminuye los costos del proceso. Además, el fosfato es un compuesto fisiológico, más barato que el Tris.
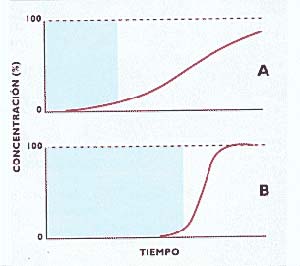
Por último, se determinaron los parámetros relevantes para pasar, mediante cromatografía frontal, de la escala de laboratorio a la industrial. La técnica consiste en cargar la muestra continuamente en la columna, hasta el momento en que no sea retenida por haberse saturado la capacidad de la matriz. Por supuesto, interesa que la columna retenga la mayor cantidad posible de proteína y que su salida sea abrupta. La figura 5 indica la cantidad de muestra que sale de la columna en función del tiempo: los trazados se conocen como curvas de ruptuna y la cromatografía será tanto más eficiente cuanto mayor sea la pendiente de esa curva (5B), ya que la carga de la columna debe finalizar cuando comienza a salir la proteína que se quiere adsorber. La forma de la curva de ruptura depende de la matriz cromatográfica y de las condiciones operativas (flujo, concentración de muestra, etc.).
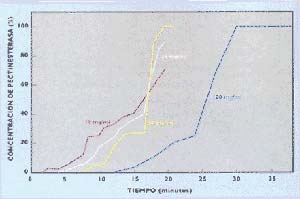
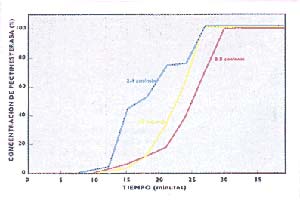
La figura 6 muestra las curvas de ruptura para distintas velocidades a las que la muestra atraviesa la columna. Es preferible el flujo más rápido, que permita conseguir la mejor carga de muestra en la columna, para que el proceso sea más económico: en este caso, una velocidad de 0,80cm por minuto cumple con ambas condiciones. La figura 7 revela el mismo fenómeno con relación a la concentración de muestra sembrada: se pudo obtener una buena curva de ruptura con la máxima concentración utilizada – 100mg/ml- (no es posible usar concentraciones mayores por la solubilidad de la muestra).
En conclusión, mediante los métodos descriptos, hemos podido establecer las mejores condiciones de separación de la enzima pectinesterasa de la pectínliasa, y encontrar una forma simple y económica de preparar jugos de frutas más sanos. Hemos cumplido con la parte de la tarea que compete a los científicos; ahora la industria podrá considerar si esta en condiciones de sacar provecho de la posibilidad que queda abierta.











