Disertación pública del último premio Nobel de química sobre su tema principal de trabajo, que reviste candente actualidad en el sur de las Américas.
Síntesis de las exposiciones, preguntas y respuestas correspondientes a una sesión académica para público general celebrada en la Biblioteca Nacional, en Buenos Aires, en marzo de 1996.
La reunión fue organizada por el INQUIMAE (FCEyN, UBA) y la Asociación CIENCIA HOY y contó con el apoyo de la Fundación Banco Mayo.
EXPOSICIÓN DEL PROFESOR MOLINA
Voy a hacer una presentación general sobre la capa de ozono de la estratosfera. Sí bien desde hace siglos la humanidad sabe que es posible contaminar los ríos, las ciudades y el aire de estas, sólo en años recientes, quizá durante las últimas dos décadas, con las alteraciones al ozono estratosférico, se ha dado cuenta de que podría contaminar todo el planeta. Ha comenzado a tomar conciencia de que enfrenta un problema global. Una ayuda para comprender sus dimensiones es considerar el espesor de la atmósfera. FI 90% de la masa de aire que la compone se encuentra entre la superficie de la Tierra y alrededor de 20km de altura, pero la distancia entre los dos polos terrestres es mil veces mayor: 20.000km. Se advierte que la atmósfera es una piel muy delgada del globo terrestre, en la que resalta la presencia de nubes.
Imaginemos a un viajero del espacio que se acerque a nuestro planeta y empiece a estudiarlo: si su visión fuera semejante a la de los humanos en la franja visible del espectro, notaria esas nubes. Con aparatos más refinados. podría darse cuenta de que una quinta parte de la atmósfera es oxígeno, lo que le indicaría que hay vida en la Tierra. Si se acercara más, vería muchas luces en ciertas partes de los continentes, es decir, divisaría ciudades y señales de civilización. Pero sí dispusiera de medios para percibir los rayos ultravioletas y. además, hubiese estado observando la Tierra por el lapso de un par de décadas, advertiría unos cambios muy curiosos, hasta espectaculares, sobre todo en la zona del polo sur. Notaría allí una alteración extraordinaria del color, debido a que rayos ultravioletas, que normalmente no penetraban desde el espacio hasta la superficie terrestre, comenzaron a hacerlo (porque una capa protectora que filtraba esa radiación prácticamente desaparece de la atmósfera, en esa zona, durante los meses de la primavera austral). Ante esta comprobación. nuestro hipotético viajero espacial no dejaria de preguntarse qué le podría estar pasando al planeta colocado ante sus ojos.
Para responder a ese interrogante conviene que nos remontemos un poco en el tiempo. Hacia los años cuarenta, las heladeras o refrigeradores domésticos empezaron a ser confiables y seguros. Antes de esa fecha. usaban compuestos tóxicos como refrigerante -por ejemplo. amoniaco o dióxido de azufre, lo que ocasionó un considerable número de accidentes. En la década de los treinta, un ingeniero llamado Thomas Midgley inventó unos compuestos químicos llamados clorofluorcarbonos, de gran estabilidad, para reemplazar a las mencionadas substancias tóxicas. Otra de sus invenciones fue el tetraetilo de plomo, importante en los motores de esa época, pero aquí nos interesan los clorofluorcarbonos, cuyas propiedades físicas y químicas resultaron muy útiles a la sociedad. Son compuestos no tóxicos y muy volátiles en condiciones cercanas a las del ambiente; es decir, son líquidos pero se evaporan con mucha facilidad. Tal transformación de fase, de líquido a vapor, los hace adecuados como refrigerantes y, a veces, como solventes. Su propiedad química más importante es su estabilidad. Si se los usa en una heladera, cuando esta concluya su vida útil, terminarán siendo emitidos a la atmósfera en su totalidad, pues no se habrán descompuesto.
En términos químicos, los clorofluorcarbonos son derivados de hidrocarburos. El más sencillo de estos es el metano, que se compone de un átomo de carbón y cuatro de hidrógeno; sí se reemplazan estos últimos átomos por halógenos -la familia que forman el flúor, cloro, bromo, yodo y astato-, sobre todo los dos primeros, se obtienen clorofluorcarbonos. Por la extraordinaria estabilidad que se mencionó, el uso de estos compuestos se generalizó en las décadas de los 60 y los 70, al punto que, para comienzos de la segunda. era posible medir su presencia en la atmósfera. Un científico inglés, James E. Lovelock, inventó un cromatógrafo de gran sensibilidad para hacer tales mediciones y advirtió que no sólo encontraba clorofluorcarbonos en el aíre de Londres sino, también, en el que venía del Atlántico, igual que en el de cualquier otra zona del mundo. Sus concentraciones eran muy pequeñas. del orden de partes por cada millón de millones. Pero, mediante un cálculo sencillo, se podía demostrar entonces que tales concentraciones eran las esperables sí se suponía que toda la producción industrial de clorofluorcarbonos realizada hasta el momento estaba dispersa en la atmósfera del mundo.
En aquel entonces, Lovelock y sus colegas concluyeron que la situación no era de preocupar, pues se trataba de compuestos muy poco tóxicos que, presentes en la atmósfera en concentraciones tan pequeñas, no ocasionarían problemas. Ese fue el punto de partida que elegimos con mi colega Sherry Rowland cuando decidimos estudiar la química de la atmósfera terrestre. Los dos éramos especialistas en otras ramas, pero resolvimos atacar un problema nuevo: predecir la acción de esos compuestos y sus consecuencias. Me acuerdo haber pensado que no parecía bueno estar cambiando la composición química de la atmósfera sin saber sus efectos, y que sería importante estudiar los resultados de cambios que no eran de origen natural.
Como consecuencia de las investigaciones aprendimos que los clorofluorcarbonos se descomponen si se los somete al tipo de luz ultravioleta que sólo existe en la alta atmósfera. No explicaré los detalles de los procesos químicos de esa descomposición, pero indicaré algunos factores que influyen en ella. Uno es la temperatura, que disminuye con la altura; por ello, en los Andes -en las montañas altas, en general- nieva todo el año. La temperatura desciende a medida que aumenta la altitud porque la atmósfera se calienta por abajo, debido a la energía solar que recibe la superficie de la Tierra. Pero, a cierta altura, la temperatura no sigue bajando, sino que empieza a subir, con importantes consecuencias para el funcionamiento de la atmósfera. Un perfil invertido de temperaturas, opuesto al que normalmente existe, crea una gran estabilidad de la atmósfera, sobre todo para movimientos de aire en la dirección vertical. Las nubes, los vientos y los otros fenómenos climáticos suceden casi en su totalidad en la baja atmósfera; en la estratosfera, aquella capa estable caracterizada por la inversión del perfil de temperaturas. prácticamente no hay nubes.
El aumento de la temperatura en la estratosfera se relaciona con la composición química del aire, pues, a esa altura, hay un compuesto que absorbe la energía solar y. por ende, calienta localmente la atmósfera. Es el ozono, substancia muy poco estable que absorbe la radiación ultravioleta, cosa que no hacen el oxigeno ni el nitrógeno. Los clorofluorcarbonos incorporados a la atmósfera en la superficie terrestre se mezclan con mucha rapidez con las capas inferiores de aíre (por ejemplo, compuestos emitidos en los Estados Unidos llegan a Europa en cuestión de meses y, posiblemente, en no más de dos años están en el hemisferio sur). Pero tardan alrededor de una década en alcanzar alturas suficientes en la estratosfera y en encontrar la luz ultravioleta que los descompone, que es la del tipo absorbido o filtrado por el ozono.
Una molécula conocida por todos los químicos y biólogos, el ácido ríbonucleico, que controla la herencia, también absorbe muy eficientemente luz ultravioleta, los rayos que producen las quemaduras de sol y el cáncer de piel. Posiblemente por ello, los sistemas biológicos han evolucionado para adaptarse a las cantidades de luz ultravioleta que llegan naturalmente a la superficie terrestre. Si esa cantidad aumentara, podría producir daños importantes en muchos sistemas ecológicos y, también, en el hombre.
El ozono -O3, una molécula que tiene tres átomos de oxígeno- se produce por la acción de la luz solar en el oxígeno normal que respiramos, que tiene dos átomos por molécula. Se está generando continuamente, sobre todo en los trópicos y en la alta estratosfera, y también se está continuamente destruyendo, por su escasa estabilidad. Esas destrucciones, que no puedo explicar en detalle, tienen lugar mediante muy interesantes procesos catalíticos, debidos a los óxidos de nitrógeno de origen natural, que están presentes en concentraciones del orden de partes por mil millones, pero controlan el ozono presente en partes por millón. El óxido nítrico (NO) ataca al ozono, pero se regenera a tal punto que una de sus moléculas puede destruir muchos miles de las de ozono. En la baja atmósfera, en especial en las ciudades, los óxidos de nitrógeno son responsables de la producción de ozono, por su acción (con luz solar) sobre ciertos productos de la combustión de hidrocarburos. El ozono que se produce en lo que llamamos smog es malo para respirar, porque afecta los pulmones, pero el ozono de la estratosfera es importantísimo para protegernos de la luz ultravioleta. En un caso, el dióxido de nitrógeno reacciona con átomos de oxígeno en zonas donde se produce ozono; en cambio, cerca de la superficie terrestre no hay suficientes átomos de oxigeno, y el dióxido de nitrógeno, cuando absorbe luz solar, los produce, para que, a su vez, generen ozono. Son reacciones químicas muy parecidas pero con efectos opuestos.
El cloro es también muy eficiente en estas reacciones en cadena, de suerte que un átomo de cloro puede destruir a cientos de miles de moléculas de ozono. Así se vincula el problema de los clorofluorcarbonos con el de la capa de ozono. Aquellos se emiten en la superficie terrestre y son tan estables que no se eliminan de la atmósfera por los procesos normales por los que esta se limpia, como la lluvia. Cualquier compuesto soluble en agua se elimina de esa manera: ello puede tener consecuencias desfavorables, pero cumple con un cometido importante, que es purificar la atmósfera. La lluvia ácida, a pesar de sus efectos nocivos, por lo menos elimina del aire ácidos, que podrían tener repercusiones igualmente malas o peores. Otros procesos destruyen compuestos no solubles en agua; por ejemplo, la oxidación atmosférica, sobre todo con el radical hidroxilo, pero tampoco actúan sobre los clorofluorcarbonos, de suerte que, a pesar del prolongado tiempo que estos tardan en difundirse, finalmente alcanzan alturas por encima de la capa de ozono, se destruyen y producen átomos de cloro.
En 1974, lo anterior no era más que una hipótesis formulada por nuestros grupos de trabajo, muchos de cuyos aspectos se comprobaron -como la presencia de átomos de cloro y moléculas de óxido de cloro en la estratosfera-, pero resultó muy difícil medir sus efectos en el ozono mismo, sobre todo por las fluctuaciones de este, que se produce principalmente en las latitudes tropicales y migra hacia los polos. Esas variaciones naturales ocultan los efectos que puedan tener los compuestos industriales, salvo que sean enormes. Pero, en 1985, un grupo de científicos británicos descubrió que sobre la Antártida estaba sucediendo algo de lo que no se conocían antecedentes: en la primavera antártica el ozono estratosférico desaparecía drásticamente, fenómeno que se sigue apreciando hoy, diez años después.
Sí examinamos con un poco más de detalle lo que le pasa al ozono estratosférico sobre el polo sur, a la luz de mediciones hechas con globos por mí colega David Hoffman, quien estableció perfiles de ozono, o sea, la concentración de ozono en función de la altitud, advertimos que cuando sale otra vez el Sol en la Antártida, después de la larga noche polar, el ozono tiende a desaparecer rápidamente. En cuestión de semanas, para octubre, ya no es posible medirlo en un radio de alrededor de 5km en torno al polo. Más del 99% del ozono desaparece; con el tiempo se regenera, cuando la masa de aire que contiene el agujero de la capa de ozono se mezcla con aire que tiene cantidades más normales del gas. Al descubrirse este fenómeno, la pregunta que se hizo la comunidad científica fue si era de origen natural o si, efectivamente, se debía a la presencia de cloro de proveniencia industrial.
Para responderla, se formularon distintas hipótesis, que se comprobaron o refutaron mediante experimentos diseñados al efecto. Nuestro grupo no predijo que el ozono desaparecería con más intensidad sobre la Antártida, porque no tomó en cuenta la presencia de nubes. La estratosfera es muy seca, porque casi toda el agua baja como lluvia antes de llegar a esas alturas. Pero sobre la Antártida la atmósfera es muy fría, varios grados más fría, incluso, que sobre el Ártico, por lo que se forman más nubes. Estas desempeñan un papel importante en el comportamiento químico del aíre, que consiste en activar el cloro. Normalmente, el cloro procedente de la descomposición de los clorofluorcarbonos forma parte de compuestos estables, como el ácido clorhídrico, el nitrato de cloro, etc. La descomposición del ozono, en cambio, se debe a la presencia de radicales libres -compuestos de gran reactividad, dotados de un número impar de electrones-. Habíamos pensado que la cantidad de cloro activo sería muy pequeña. sobre todo en los polos, por las bajas temperaturas: que, normalmente, no más del 2-3% del cloro tendría la forma de radical libre. Pero, con la presencia de las nubes, ocurren reacciones, catalizadas por las partículas de hielo de aquellas, de las que no había antecedentes, y que dan como resultado la formación de cloro molecular, un gas verde que constituye uno de los elementos naturales. En cuanto sale el Sol sobre la Antártida, aunque la intensidad de su luz sea muy pequeña, el cloro la absorbe en cantidad suficiente para que se rompan sus moléculas y resulten átomos de cloro activo, capaz de destruir el ozono. Por ello, sobre la Antártida, no un pequeño porcentaje, sino las dos terceras partes del cloro están en esta forma activa. Otra función importante de las nubes es eliminar los óxidos de nitrógeno, que interfieren con el cloro en cuanto a sus efectos sobre el ozono.
También quiero explicar brevemente otra reacción química, que tiene lugar mediante procesos catalíticos independientes de la presencia de átomos de oxigeno, pero con la de un compuesto antes desconocido, el peróxido de cloro (C1202). Es otro ejemplo de un descubrimiento fundamental que, al mismo tiempo, tiene una aplicación directa a la química de la atmósfera. Una propiedad interesante de la molécula de C1202 es que, cuando absorbe luz, libera átomos de cloro. Demostramos lo anterior con unos experimentos de laboratorio realizados, principalmente, por Agustín Colussi, profesor de la Universidad de Mar del Plata e investigador del CONICET. Sí en el laboratorio se puede hacer que los átomos de cloro destruyan el ozono y se logra medir el proceso, se adquiere confianza en que ello ocurrirá en la estratosfera, así como en cualquier otro sitio donde se encuentren átomos de cloro y moléculas de ozono. Por este camino, hicimos la predicción de que el cloro era responsable de la desaparición del ozono en la Antártida. Realizamos otro experimento, que consistió en medir la concentración de los gases estables en las porciones de la estratosfera de las que estaba desapareciendo el ozono. De acuerdo con una de las teorías, la meteorológica, no habría destrucción química del ozono sino, simplemente, movimientos de aíre: capas con muy poco ozono que suben y desplazan a otras ricas en él. Ello se pudo refutar muy fácilmente, porque la concentración de ciertas substancias, como el metano y los clorofluorcarbonos, varia con la altitud: midiendo la concentración de estas se estableció con claridad que el aíre en cuestión no venía de altitudes menores sino, en todo caso, de más arriba, y que había destrucción química del ozono. Otra de las teorías postulaba una mayor concentración de óxidos de nitrógeno de origen natural, asociada con los ciclos solares, pero las mediciones demostraron que los niveles de estos óxidos son extraordinariamente bajos y acordes con las predicciones hechas sobre la base de los experimentos de laboratorio que mencioné. En ausencia de óxidos de nitrógeno, el cloro puede destruir el ozono con extraordinaria eficiencia.
Uno de mis colegas de Harvard -James G. Anderson- y su grupo de investigación midieron las concentraciones estratosféricas de ozono y de óxido de cloro, que es el cloro activo, en distintas latitudes. Cuando el avión desde el que realizaban las mediciones entraba en la zona polar de la que estaba desapareciendo el ozono. advertían que. al principio, cuando el ozono todavía estaba presente en cantidades normales, ya era posible encontrar concentraciones relativamente elevadas del radical y. a medida que desaparecía el ozono, se verificaba una fuerte aumento de aquel, lo que fundamenta la marcada correlación del cloro activo con la desaparición del ozono. La cantidad de cloro activo es tan grande que se lo puede medir desde un satélite por la emisión de microondas, una operación que se asemeja a lo que comenté al principio sobre un observador que contemplara el planeta desde el espacio y tuviera la capacidad de percibir los rayos ultravioletas. Las concentraciones más altas de cloro activo, igual que las más bajas de ozono, coinciden con la masa de aire estratosférico que se distingue del resto por su temperatura mucho más baja y se llama vórtice polar, donde más de la mitad del cloro está en la forma activa.
Es interesante notar que también hay concentraciones muy elevadas de óxido de cloro en el hemisferio norte, pero no hay un agujero en la capa de ozono, como en el sur, porque el vórtice polar es menos estable. La capa de ozono también se deteriora sobre el Ártico, pero no de manera tan localizada como sobre la Antártida: sufre un adelgazamiento de alrededor del 10-20%, en un área geográfica más extensa que la del agujero del sur La causa es que las temperaturas no son suficientemente bajas y el tiempo no alcanza para que los procesos catalíticos destruyan al ozono en el hemisferio norte, o en el polo norte, como lo hacen en el sur, pero, de todas maneras, las mediciones muestran claramente que, en los últimos años, la concentración medía de ozono en el globo ha bajado de manera muy significativa.
¿Qué se ha hecho acerca de este problema? Lo primero fue dejar de utilizar clorofluorcarbonos como propelentes de los aerosoles de uso doméstico. Las latas de aerosol necesitan una substancia que, a la presión moderada practicable dentro del recipiente, sea líquida y, al apretar el botón, se evapore y arrastre el compuesto activo. En 1978, y a pesar de que todavía no se había comprobado experimentalmente nuestra teoría por mediciones atmosféricas, se prohibió el uso de clorofluorcarbonos en aerosoles en los Estados Unidos, Canadá y los países escandinavos; de todos modos, no eran indispensables, porque había otras substancias que podían tomar su lugar. Entonces se tenían claros ciertos aspectos de la química de la atmósfera, pero el ozono estratosférico todavía no había desaparecido sobre el polo sur. En la Argentina, por esos años se dejaron de emplear clorofluorcarbonos en la mayoría de los aerosoles, pero sólo alrededor de 1990 se promulgó la ley que prohibió usarlos para tal finalidad. Sin embargo, se admitió que continuaran utilizándose para otros propósitos, como la refrigeración y los solventes.
En 1987, se firmó un acuerdo internacional, el protocolo de Montreal, cuya primera versión estableció que se limitaría la producción de clorofluorcarbonos y fijó que se la reduciría a la mitad de la actual para fines del siglo. Pero, a la luz de la evidencia científica que se fue acumulando, el protocolo original se enmendó, primero en Londres y después en Copenhague, de suerte que, a fines del año pasado, esa producción se detuvo por completo en los países industrializados, aunque es posible que continúe, con una intensidad relativamente pequeña, en los países en vías de desarrollo, lo que se admite durante el tiempo de transición a técnicas no dañinas. Como los compuestos analizados tienen una vida medía de cincuenta años, o de un siglo en la atmósfera, se estima que esta se va a recuperar muy lentamente. y que sólo a media dos del siglo próximo va a desaparecer del hemisferio sur el agujero en la capa de ozono, lo mismo que su adelgazamiento en el norte.
El protocolo de Montreal demuestra que es posible que la humanidad resuelva los problemas ambientales con eficiencia. Una de sus características importantes es que intervinieron muchos sectores de la sociedad: la comunidad científica, diplomáticos, la industria. Al principio esta se oponía a que se sancionaran las reglamentaciones, pero, con el tiempo, se convenció de que el problema era muy serio y, desde 1988, colabora en el proceso de definirlas; por ejemplo, proporciona información acerca cuánto tiempo se requiere para crear procesos substitutivos. La solución del problema no consiste en dejar de usar refrigeración o aíre acondicionado, sino, simplemente, en buscar otras técnicas, que no deterioren el ambiente. Algunas de las nuevas se basan en compuestos parecidos a los clorofluorcarbonos, los hcfcs (clorofluorcarbonos hidrogenados), que son menos estables. Una proporción pequeña de ellos llega a la estratosfera, pero la mayoría se descompone en la baja atmósfera.
Uno de los aspectos más importantes de la crisis del ozono estratosférico es que constituye un asunto realmente global. Los clorofluorcarbonos son emitidos principalmente en el hemisferio norte, pero sus efectos más graves se constatan en el lugar del globo lo más alejado posible de ese hemisferio, la Antártida. Entre las consecuencias del incremento de la radiación ultravioleta se cuenta la menor productividad del fitoplancton, que, a su vez, podría tener repercusiones que van mucho más allá de los mares del extremo sur A pesar de que, vistos desde los países con mayor participación en las causas, los efectos directos están muy lejos, los indirectos sobre esos mismos países pueden ser importantes. Desde luego, en la Argentina, en especial en la Tierra del Fuego, cuando se produce el agujero de la capa de ozono se reciben intensidades de radiación ultravioleta mayores que las naturales, con las consiguientes repercusiones sobre los seres vivos, incluida la población humana.
Para terminar, quiero hacer una referencia a los distintos tipos de investigaciones que se están realizando hoy en estos campos. Están las de laboratorio, como las que hacemos con mí grupo en el Massachusetts Institute of Technology; también se llevan a cabo mediciones en la atmósfera, y hay grupos importantes que formulan modelos matemáticos, que se basan en los datos experimentales y las mediciones para predecir cómo funciona la atmósfera. Me gusta concebir esos modelos matemáticos como mapas de la atmósfera, y recordar, a ese propósito, una cita de Jorge Luis Borges que lleva el titulo Del rigor en la ciencia (está en El hacedor; en un apartado llamado Museo, y figura en la página 847, tomo 1, de sus Obras Completas 1923-1972. Emecé, Buenos Aires, 1974). Leí en Estocolmo el pasaje traducido al inglés, en mí discurso de recepción del Nobel. Aquí puedo citar el texto original, que reza: ..En aquel Imperio, el Arte de la Cartografía logró tal Perfección que el mapa de una sola Provincia ocupaba toda una Ciudad y el mapa del Imperio, toda una Provincia. Con el tiempo, esos Mapas Desmesurados no satisficieron y los Colegios de Cartógrafos levantaron un Mapa del Imperio, que tenia el tamaña del Imperio y coincidía puntualmente con él. Menos Adictas al Estudio de la Cartografía, las Generaciones Siguientes entendieron que ese dilatado Mapa era Inútil y no sin Impiedad lo entregaron a las Inclemencias del Sol y de los Inviernos. En los desiertos del Oeste perduran despedazadas Ruinas del Mapa, habitadas por Animales y por Mendigos; en todo el País no hay otra reliquia de las Disciplinas Geográficas. Es pues, el rigor en la ciencia.
EFECTOS DE LA RADIACIÓN ULTRAVIOLETA SOBRE LAS PLANTAS
La erosión de la capa de ozono estratosférico y el aumento concomitante de la radiación ultravioleta preocupan, entre otras razones, por sus consecuencias sobre las plantas, los productores primarios de los ecosistemas. Lo que sigue es una síntesis muy apretada de lo que sabemos acerca de cómo responden las plantas a cambios en el nivel de radiación.
La radiación ultravioleta es una parte muy pequeña del conjunto de la luz solar que recibe la superficie del planeta, pues constituye entre un 7% y un 10% de esta. Conviene distinguir entre la radiación ultravioleta A y B, que se diferencian por su longitud de onda -UVA, entre 320 y 400 nanómetros (nm), y UV-B, entre 290nm y 320nn~. El UV-B, o la radiación cuya longitud de onda es menor que 320nm, es más importante desde el punto de vista biológico, porque muchos de los efectos del ultravioleta sobre los organismos vivos son extremadamente dependientes de la longitud de onda: a medida que esta disminuye, aumenta notablemente la eficiencia relativa de la radiación en inducir una respuesta biológica. Por otro lado, la radiación de onda más corta es la más afectada por la erosión de la capa de ozono. Por lo tanto, un cambio relativamente pequeño en cantidad de radiación ultravioleta que llega a la Tierra debido a ese fenómeno puede tener consecuencias biológicas Importantes.
Es posible calcular los cambios en la radiación ultravioleta biológicamente efectiva causados por determinadas variaciones en la concentración de ozono estratosférico, por ejemplo, ponderando el aumento de radiación ultravioleta de distintas longitudes de onda por sus respectivas capacidades para causar daño en los ácidos nucleicos. Si bien no tenemos buenos datos acerca de cuánta radiación ultravioleta biológicamente efectiva incidía sobre la Tierra hace veinte años, uno de los efectos positivos del descubrimiento del agujero en el ozono estratosférico ha sido que se establecieron redes de medición de la radiación ultravioleta que ahora incide en distintas partes del globo, tarea en la que la National Science Foundation de los Estados Unidos tuvo un cometido destacado. También en la Argentina se realizan esas mediciones, las que llevaron a concluir que, por ejemplo, en Ushuaia, al principio de la primavera, se producen aumentos significativos de la radiación ultravioleta B incidente.
Algunos procesos metabólicos de las plantas relacionados con la fotosíntesis u otros directamente vinculados con la actividad génica son afectados por esta última radiación. Desde los años setenta, ha sido clásico relacionar un incremento de la radiación ultravioleta con la inhibición de la fotosíntesis, el proceso por el cual las plantas transforman energía solar en química La magnitud de tal efecto depende mucho de una serie de otros factores ambientales; normalmente es más difícil encontrar Inhibiciones marcadas de la fotosíntesis en plantas que crecen en condiciones naturales, comparadas con las que crecen en las condiciones artificiales de un laboratorio, aunque la fotosíntesis también puede verse afectada en las primeras, como lo indican los estudios realizados sobre la reducción de la productividad primaria del fítoplancton en aguas antárticas.
Las plantas terrestres son también sensibles en cuanto a su morfología a cambios en el nivel de radiación ultravioleta. Un aspecto morfológico crucial para la competencia entre plantas vecinas es el alargamiento. Cuando crecen en condiciones de alta densidad, las más altas llevan una ventaja competitiva, porque pueden capturar más luz. Se han estudiado los efectos de la radiación ultravioleta (además de otras cosas) y se ha encontrado que ejerce una acción inhibitoria del alargamiento de los tallos. La superficie foliar también tiene importante interés, porque determina el tamaño de la superficie foto-sintética, la que capta fotones para el proceso de fotosíntesis Es bien conocido que la radiación ultravioleta inhibe la expansión de la superficie foliar, con consecuencias sobre el crecimiento y la acumulación de biomasa. Si se comparan plantas que crecen con radiación ultravioleta B y sin ella, es común encontrar diferencias en la tasa de expansión foliar y en el ritmo de incremento de peso.
Las plantas no son organismos estáticos y, al igual que muchos otros, echan mano a variados recursos para protegerse de niveles altos de radiación ultravioleta. Uno es la síntesis y acumulación de pigmentos fotoprotectores en la epidermis de las hojas y de otros órganos expuestos al sol. Genéricamente, esos pigmentos se denominan flavonoides y tienen una complejidad química considerable. Son substancias que se acumulan en la epidermis y absorben radiación ultravioleta, con lo que reducen la cantidad que penetra al resto de los tejidos. Las plantas también tienen sistemas que les permiten reparar el daño causado por la radiación ultravioleta a los ácidos nucleicos, uno de los más típicos de los cuales es la formación de dímeros entre bases de pirimidina. Con la ayuda de un anticuerpo que reconoce específicamente esos fotoproductos, es posible medir el daño inducido por la radiación ultravioleta en el ADN, y estudiar los mecanismos de defensa y adaptación de las plantas.
Sobre la base de los recientes progresos, esperamos estar en condiciones de predecir y, eventualmente, modificar las respuestas de las plantas a cambios en la radiación ultravioleta, los que pueden ocurrir como consecuencia de la erosión de la capa de ozono o por otros factores no necesariamente asociados con ella. Un aspecto importante es explorar qué sucede cuando, en lugar de tomar una única planta en una maceta como objeto de estudio, se consideran las respuestas de un cultivo completo o un ecosistema natural.
Carlos Ballaré
EFECTOS DE LA RADIACIÓN ULTRAVIOLETA SOBRE LOS ECOSISTEMAS
Las respuestas de la célula y la planta se extrapolan a mundos de mayor complejidad, como son los ecosistemas. En biología, sin embargo, la extrapolación es bastante difícil y los enfoques reduccionistas generalmente tienen éxito limitado. Ello se debe a la gran cantidad de interacciones. La radiación ultravioleta afecta el crecimiento de las plantas y el equilibrio competitivo. En otras palabras, al diferir unas de otras las reacciones de las plantas (y animales) a cambios en la radiación ultravioleta, porque tienen mayor O menor capacidad de res-puesta, se puede alterar el equilibrio de las distintas especies y, por lo tanto, la composición específica. Pueden ocurrir extinciones y una menor diversidad biológica. Además de las variaciones en el crecimiento, están las morfológicas -por ejemplo, la mayor o menor altura-, que, nuevamente, pueden resultar en cambios en el balance competitivo. También hay transformaciones más sutiles, cuyas consecuencias no son despreciables, como un desplazamiento del momento de polinización. Algunas plantas adelantan su floración y otras la retrasan, debido a la mayor radiación ultravioleta, pero los insectos que las polínizan pueden tener una respuesta distinta y, en el momento requerido por las plantas, haber una población muy disminuida de insectos POlinizadores. Como se ve, que se altere el momento en el cual ocurren fenómenos como la polinización, el crecimiento o la germinación también afecta el balance competitivo.
Por otro lado, como respuesta a la radiación ultravioleta, ciertas plantas cambian la composición de substancias como los flavonoides o la relación celulosa/lignina, lo que afecta su consumo por parte de los herbívoros y la descomposición de la materia orgánica vegetal cuando cae al suelo, donde los microorganismos se encuentran con un sustrato distinto. Por lo tanto, varía la tasa de recirculación de nutrientes, la que generalmente se hace más lenta, con el consiguiente efecto sobre las mismas plantas que requieren esos nutríentes minerales o inorgánicos.
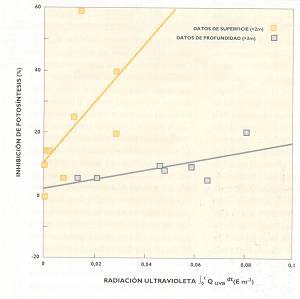
En la figura I, el eje de las x mide cantidad de radiación ultravioleta y el de las y, inhibición de la fotosíntesis. El gráfico indica la variación del fenómeno con relación al agujero del ozono, en las capas superficiales del océano, hasta los 20m de profundidad. Se advierte la disminución de la fotosíntesis en un ecosístema cuyos productores primarios son las algas, que alimentan a herbívoros. Es una demostración del efecto directo de la radiación ultravioleta sobre la productividad primaria, pues a medida que aumenta la concentración de la cantidad de aquella, disminuye esta. En la revista Scíence se publicó un artículo que, aparentemente, contradecía estos resultados. Se trataba del análisis del comportamiento de otro sistema acuático, en el cual (Fíg. II) se midió la cantidad de clomfila de las algas como estimador de la biomasa, es decir, la cantidad de estas.
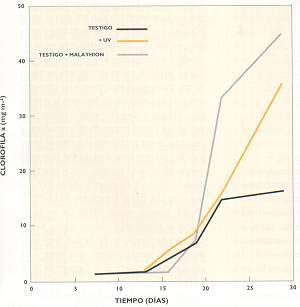
A mayor radiación ultravioleta se encontró mayor cantidad de clorofila o de masa de algas. El hallazgo se terminó explicando por el hecho de que, si bien los productores primarios, las al-gas, disminuían por la radiación, los herbívoros que se alimentaban de ellas lo hacían en mayor medida, porque eran mucho más sensibles al ultravioleta. Es decir, la radiación ultravioleta afectaba más a los que comían las algas que a estas. Es un ejempío claro de cómo es muy difícilpoder predecir la respuesta de ecosístemas complejos, aun cuando conozcamos cómo funcionan sus partes.En experimentos realizados en Buenos Aíres se encontró que, a medida que aumentaba la radiación ultravioleta recibida por ciertas plantas, disminuía el ataque por insectos. La razón podía ser tanto que se producía un cambio en las hojas, es decir, en la calidad de la comida de esos insectos, O que la radiación afectaba directamente a estos.
Aislando las dos variables, se demostró que el efecto más importante ocurría por la alteración de la composición química de las hojas, por encima del ocasionado por los rayos ultravioleta a los insectos.
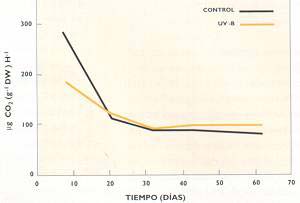
En un experimento llevado a cabo en Suecia, que ilustra la fi-gura III, se buscó medir las consecuencias de los cambios de la composición química de las hojas verdes. Esta repercute sobre la de las hojas muertas, que caen al suelo, son descompuestas por microorganismos y transforman los nutrientes orgánicos en nutríentes inorgánicos, la fuente de minerales para las plantas.
Se verificó la cantidad de dióxido de carbono producido por los microorganismos, como indicador de la velocidad con la cual se descompone la materia orgánica. Se advirtió cómo los cambios en la composición química de las hojas inducidos por la radiación retar-dan la velocidad de la descom~ sición de la matería orgánica.
Osvaldo Sala
PREGUNTAS DEL PÚBLICO
¿Qué solución hay para los refrigeradores que sea inofensiva para el ambiente y económicamente factible? ¿Cómo sabemos realmente que no será dañina?
Hay que usar otros compuestos que los clorofluorcarbonos. Los hay de dos tipos. Unos son los llamados hcfcs, que incorporan átomos de hidrógeno en las moléculas de los primeros. lo que los hace considerablemente menos estables y conduce a que una porción mucho menor de la emisión llegue a la estratosfera. Lo último se puede medir y comprobar tanto en el laboratorio como en la atmósfera. No es la solución perfecta, puesto que algo de cloro alcanza la estratosfera. El protocolo de Montreal permite el uso de esos compuestos por un cierto período, en la expectativa de que. entre tanto, se encuentren técnicas completamente libres de ese efecto. El otro tipo de soluciones se basa en substancias sin cloro que puedan servir como refrigerantes. El conocimiento fundamental de cómo se comporta la atmósfera, que se obtiene con mediciones tanto en la realidad como en el laboratorio, es el único camino que nos llevaría a saber si alguna solución es realmente inocua. La comunidad científica está haciendo estudios muy detallados de los posibles efectos de distintos compuestos, porque la industria no quiere tomar el riesgo de hacer fuertes inversiones y después darse cuenta de que las técnicas siguen siendo nocivas; por ello, financia en parte muchos de esos estudios. Por ejemplo, en un momento se dudaba sí el flúor. a diferencia del cloro, podía ser inocuo para la estratosfera: la conclusión fue que sus efectos son mucho menores.
A propósito, otros compuestos químicos, como los llamados halones, que tienen bromo, se usan como muy eficientes extínguidores de incendios. El bromo, llegado a la estratosfera, seria mucho más eficaz que el cloro para destruir el ozono. Por fortuna, es más caro y hay mucho menos bromo. Los haIones también han sido incluidos en el protocolo de Montreal y se permiten para ciertos usos, como extinguidores de aviones, de la misma manera que se autoriza el uso de clorofluorcarbonos en determinados aerosoles medicinales. En todos esos casos las cantidades que podrían emitirse a la atmósfera son muy reducidas.
Quienes argumentan en contra de eliminar los clorofluorcarbonos de origen industrial sostienen que la cantidad de cloro liberado por procesos naturales, como volcanes, etc., es mucho mayor que el proveniente de aquellos, los cuales, entonces, no serían importantes. ¿Puede aclarar esta cuestión?
El cloro de origen natural que llega a la atmósfera se puede medir Hay, efectivamente, producción natural de compuestos con cloro, como el ácido clorhídrico. relativamente abundante en los océanos, pero es un producto soluble en agua. de manera que su concentración en la atmósfera es pequeñísima y en la estratosfera. menor aún. La única manera de que el cloro llegue a esta última es formando parte de compuestos muy estables que asciendan a esas alturas, lo que también se puede medir Los volcanes, potencialmente, pueden mandar cloro a la estratosfera y algunos, como el de Chichón, en México, aparentemente lo han hecho, pero en cantidades imperceptibles. El efecto mayor de los volcanes es depositar dióxido de azufre. La mayor parte del cloro, la ceniza y todo lo que emite el volcán, aunque ascienda de manera explosiva a la estratosfera, baja muy pronto en su casi totalidad a tierra. En la estratosfera se queda el dióxido de azufre, un gas volátil que con el tiempo se oxida y produce ácido sulfúrico. El volcán Pinatubo, de las Filipinas, depositó mucho azufre en la estratosfera. Las partículas de ácido sulfúrico que se formaron aceleraron el efecto del cloro industrial. La existencia de volcanes no influye de modo directo, como fuente de cloro, sino por su efecto indirecto de acelerar las reacciones del cloro industrial. El hecho de que el cloro de origen natural no constituya un factor dominante no se basa solamente en especulaciones sino en mediciones y está muy bien documentado.
¿En qué medida la destrucción del ozono está vinculada con el efecto invernadero?
Se trata de efectos distintos, pero hay muchas conexiones entre los dos problemas. Los clorofluorcarbonos absorben radiación infrarroja de manera muy eficiente, por lo que contribuyen al efecto invernadero. Por otro lado, el ozono también absorbe rayos infrarrojos de manera eficiente: la disminución del ozono, entonces, compensa la absorción de infrarrojo que hacen aquellos. Una de las consecuencias importantes del efecto invernadero, el calentamiento de la superficie terrestre, es muy difícil de calcular o predecir, por la complejidad del sistema. Lo más sencillo de predecir es que se va a enfriar la estratosfera por radiación y, al hacerlo, habrá más nubes, lo que puede acelerar los efectos del cloro. Posiblemente esas sean las dos conexiones más importantes, aunque hay otras.
Se afirma que la capa de ozono se restablecería aproximadamente entre los años 2050 y 2070, pero sólo si se respetan estrictamente los acuerdos que obligan a eliminar la producción de clorofluorcarbonos. ¿Qué posibilidades hay de que ello ocurra y en qué pueden los científicos ayudar?
Hasta ahora, los países industrializados han cumplido con el protocolo de Montreal, pues todos han parado la producción de clorofluorcarbonos. Hay. sin embargo. situaciones que llevan a temer que se eluda ese cumplimiento. como el caso de Rusia y otras ex repúblicas soviéticas, por los problemas económicos que tienen. Pero por otro lado, como ya empieza a bajar la concentración de esos compuestos en la atmósfera, y existe la posibilidad de hacer mediciones bastante precisas. de producirse transgresiones a los acuerdos, será posible establecer dónde se localiza el incumplimiento. Esa es la contribución de los científicos. No se trata de mediciones en la estratosfera sino en la baja atmósfera. Creo, por ello. que es poco probable que algún país no cumpla con el protocolo de Montreal. porque seria muy fácil ponerlo en evidencia. Finalmente, es importante que los países en vías de desarrollo también adhieran y pongan en práctica el tratado.
En los modelos, ¿se han tenido en cuenta los ciclos de variaciones de ozono que tienen lugar en tiempos geológicos?
Lo que preocupa, y ha dado en llamarse el problema del ozono, es algo que acontece con gran rapidez y está por ello fuera de los tiempos geológicos. Es posible que en esa escala temporal haya fluctuado el ozono, pero en tal caso lo habrá hecho con suficiente lentitud como para permitir a los ecosistemas adaptarse. Vemos con toda claridad que esa adaptación no puede suceder en lapsos de una o dos décadas, tiempos que configuran cambios excesivamente bruscos para los sistemas ecológicos.
Los datos obtenidos en las mediciones indican que una parte substancial de la destrucción de la capa de ozono ocurre en la estratosfera inferior. ¿Sabemos qué papel desempeñan las regiones inferiores de la atmósfera y aquellas alejadas de los polos?
La situación sobre la Antártida no deja lugar a dudas, porque las señales que se obtienen son gigantescas y clarísimas. Se ha podido verificar empíricamente que el ozono desaparece de la alta estratosfera por procesos que responden a las reacciones en cadena que originalmente habíamos postulado. El ozono no sólo se destruye en las regiones polares sino, igualmente, en sitios que coinciden con menores latitudes y en la baja atmósfera. Sabemos que ello sucede mediante reacciones del tipo de las que tienen lugar en las nubes de nieve de los polos, pero ignoramos cómo suceden esas reacciones. Aparentemente, los modelos matemáticos en uso están vaticinando menos destrucción de ozono que la que se está observando, aunque hay ciertos datos recientes que empiezan a explicar la diferencia. Unos se relacionan con los compuestos de bromo, específicamente con la hidrólisis del nitrato de bromo, un camino muy eficiente para generar radicales hidroxilo. Es así como resultados de nuevas investigaciones están empezando a mostrar menores diferencias entre previsiones basadas en conocimientos químicos y meteorológicos y observaciones de en qué medida y con qué rapidez relativa el ozono está, efectivamente, desapareciendo sobre los polos.
¿Cuál es su opinión sobre la teoría gaia -o gea- formulada por el doctor Lovelock, que usted mencionó? (véase ‘Gaía, la Tierra vive”, CIENCIA Hoy, 16:20-24).
La teoría gea postula que la Tierra funciona como si fuera un organismo vivo y, en consecuencia, reacciona ante los cambios que vayan teniendo lugar. Se adapta a ellos como los seres vivos se adaptan y cambian en el proceso de la evolución. Conozco bien a Jim Lovelock, que es mí colega. En términos cósmicos, uno no debería preocuparse demasiado por estas cuestiones, porque, por lo menos en principio, el cosmos no desaparecería porque los hombres alteremos los fenómenos químicos de la atmósfera. Si la contaminamos de manera drástica en relación con la actual forma de la vida en la Tierra- la propia atmósfera o el planeta responderán de alguna manera, que podría incluir la desaparición de esa forma de vida. incluyendo la humanidad, pero el cosmos seguirá su derrotero, sea cual fuere. Desde un punto de vista muy general, se puede decir que la Tierra funciona, sin duda, como un organismo, y que, efectivamente, hay analogías entre las reacciones de los seres vivos y nuestro planeta tomado como una unidad, porque responde como un sistema. Pero gea no es, en mi opinión, una teoría científica rigurosa. La veo más bien como una formulación poética. Es una idea interesante, pero no proporciona predicciones especificas. Nos ayuda a tomar conciencia de los feedbacks, o procesos de retroalimentación, que se producen, sin considerar los cuales es imposible comprender el funcionamiento global del planeta.
¿Tiene sentido dedicarse a la Investigación en países en desarrollo, como México o la Argentina?
Es una cuestión compleja. Desde luego que tiene sentido hacer investigación en países en vías de desarrollo, como lo son la Argentina y México. Desde de un punto de vista personal, uno siempre duda de si obtendrá suficientes fondos para poder dedicarse a ella. Pero desde el punto de vista de la política nacional, es evidente que la investigación constituye una inversión fundamental para el desarrollo del país, por permitirle utilizar la tecnología contemporánea y. en especial, por llevarlo a saber cómo manejarse con la importada y eliminar las dependencias ciegas. Pero, además, la investigación es un componente de la educación: para alcanzar un nivel alto de educación es indispensable tener, por lo menos, un número pequeño de personas dedicadas a la ciencia, en comunicación directa con el resto de la comunidad académica internacional, de modo que estén al día. Y en mí campo particular, que podríamos tomar a modo de ejemplo, es importantísimo que haya científicos en la Argentina con opiniones y conocimiento sobre la contaminación local. Ellos darían lugar a que el país pueda participar. con el resto de la comunidad de naciones, en las discusiones y decisiones acerca del destino del planeta.
La Argentina contribuye y es afectada por la contaminación global; infringe y sufre contaminación de otros países. Es evidente que requiere tener expertos en estos campos.
¿Cuán limpias son las tecnologías limpias?
Reflexionar sobre esta pregunta presupone hacerlo sobre cómo debe evolucionar la sociedad. Por un lado, parece indispensable que los países en vías de desarrollo se continúen desarrollando. Por otro, no podemos soñar en una limpieza total, porque no existen esas tecnologías. Y resulta razonable que así sea. Pero las dos afirmaciones que acabo de hacer no constituyen constataciones o teorías científicas, sino juicios de valor ¿Hasta qué punto es necesario sacrificar el mejoramiento económico para conservar el ambiente? Es un hecho que este está cambiando. Todos deseamos que esos cambios sean los menores posibles, y queremos preservar el medio para que las generaciones futuras tengan las mismas oportunidades que tuvo la nuestra. Pero no es realista tratar de regresar siglos y soñar con un ambiente sin modificaciones. Con la cantidad de gente que existe en el planeta y con su aumento exponencial, no habrá manera de preservar el ambiente en su estado natural; habrá que tratar de entenderlo lo mejor posible para tener más opciones. En la medida en que continúen la civilización y el incremento de los estándares de vida, tendremos que crear más tecnología. Un cambio crucial de los últimos diez o quince años es que se ha tomado conciencia de la importancia de la tecnología limpia, cosa que no se valoraba antes. De allí el concepto de desarrollo sustentable, que, en esencia, consiste en tratar el ambiente de manera tal que las generaciones futuras no tengan que pagar nuestro nivel presente de vida.
Mario Molina es Lee and Geraldine Martin Professor of Environmental Sciences en el Massachusetts Institute of Technology, EE.UU. Ingeniero químico (Universidad Autónoma de México) y doctor en físico-química (University of California at Berkeley), su carrera científica se orientó al estudio de las reacciones químicas de gases. En 1974, publicó un trabajo en Nature, con el profesor Rowland, en el cual se predecía el efecto deletéreo de los clorofluorcarbonos, substancias producidas por la industria humana, sobre el ozono estratosférico. Con F. Sherwood Rowland y Paul Crutzen, recibió el premio Nobel de química 1995 por sus contribuciones al reconocimiento y comprensión de los peligros que causan a la capa de ozono substancias químicas de origen humano.
El trabajo científico de Molina es un caso paradigmático de investigación básica en físico-química. Resultados experimentales y conocimientos acumulados a lo largo de los años permitieron formular modelos que, a su vez, se usaron para efectuar predicciones con relación a problemas particulares. Un trabajo fundamental comenzado en la década de los setenta sirvió para aliviar un problema práctico hacia fines de los ochenta.











