Estamos rodeados de microorganismos patógenos, como virus, bacterias, hongos y parásitos. A pesar de tal exposición continua a agentes agresores, rara vez padecemos de infecciones graves. ¿Cómo hace el organismo para defenderse?
Este artículo está principalmente orientado a actualizar los conocimientos de quienes han tenido contacto con el tema pero desconocen sus avances más recientes. Sugerimos al lector poco familiarizado con la biología actual que, después de leer el primer párrafo, vaya al recuadro ‘Un poco de historia’ y luego consulte puntualmente los sucesivos recuadros a medida que el texto remita a ellos.
El término inmunidad deriva del latín immunitas, el privilegio en virtud del cual los senadores romanos estaban exentos de ciertos deberes cívicos. En las ciencias biológicas, inmunidad significa protección contra enfermedades, en especial, las infecciosas.
Los vertebrados –entre ellos el hombre– han desarrollado mecanismos para protegerse de las agresiones que les vienen del ambiente, causadas por bacterias, virus, parásitos y toxinas, entre otros agentes (los que reciben el nombre de patógenos, o causantes de enfermedad.
Algunos de esos mecanismos son de tipo general y constituyen una primera línea de defensa del organismo. Hablamos, así, de barreras naturales –la piel, las mucosas– y de inmunidad innata o inespecífica; de esta clase, por ejemplo, es la fagocitosis (de jagein –phageîn–, comer, y kutoV –kytos, célula), proceso por el cual ciertas células denominadas macrófagos, que se encuentran en la mayoría de los tejidos, capturan y digieren microorganismos. Decimos que esta defensa es innata porque no depende de la exposición previa al patógeno. Pero en todos los vertebrados puede activarse también una segunda línea de defensa, un sistema de reconocimiento específico del agente agresor. Tal mecanismo se denomina sistema inmune y está constituido por dos tipos de células:
(a) las células accesorias, como son los macrófagos y las células dendríticas (de dendron –déndron–, árbol, así llamadas porque poseen ramificaciones), que participan en la captura y degradación (también denominada procesado) del antígeno, y
(b) las células inmunocompetentes o linfocitos, que pueden reconocer específicamente tanto al antígeno nativo como al procesado por las células accesorias.
Las células del sistema inmune se originan durante la hematopoyesis, el proceso de formación de células sanguíneas, cuyas características les permiten cumplir funciones vitales específicas. Así, los eritrocitos o glóbulos rojos transportan oxígeno, las plaquetas promueven la coagulación de la sangre para evitar hemorragias y las células blancas o leucocitos (que incluyen a los linfocitos, los monocitos y los neutrófilos), junto con los macrófagos, forman el ejército celular del sistema inmunológico. Todas derivan de las células hematopoyéticas troncales, también denominadas células indiferenciadas multipotentes porque pueden replicarse indefinidamente y diferenciarse en varias clases de células secundarias. Estas, las precursoras, a su vez, originan líneas celulares diferenciadas (por ejemplo, los eritrocitos). Las células hematopoyéticas troncales aparecen primero en el saco amarillo embrionario, pero, a medida que el feto se desarrolla, migran al hígado. Inmediatamente después del nacimiento, la hematopoyesis pasa a ser función de la médula ósea.
Las distintas estirpes de linfocitos constituyen entre el 1% y el 10% de las células que produce diariamente el cuerpo; se encuentran principalmente en la superficie de las mucosas y en los órganos linfoides, nombre que se aplica a la médula ósea, al timo (localizado en la parte superior del pecho, detrás del esternón) y a otros órganos llamados periféricos (los ganglios o nódulos linfáticos, el bazo y ciertos tejidos asociados con el intestino, como las placas de Peyer). Existen poblaciones de linfocitos que cumplen diferentes funciones, relacionadas con el órgano linfoide en el que maduraron (o adquirieron competencia inmunológica). Los linfocitos B, productores de anticuerpos, maduran en la médula ósea (o en un órgano equivalente de las aves, denominado bursa de Fabricius, de donde proviene la denominación de linfocito B). Los linfocitos T lo hacen en el timo, donde se diferencian en linfocitos T citotóxicos (Tc), que destruyen las células infectadas, y linfocitos T colaboradores (Th, por helper), que ayudan a los B y a los macrófagos a cumplir su función.
Durante el proceso de maduración, el contacto de los linfocitos B y T con células epiteliales de los órganos linfoides respectivos les confiere competencia inmunológica; es decir, hace que adquieran una función inmunológica específica. Sin embargo, aunque cumplan diferentes funciones, las poblaciones linfocitarias son indiferenciables desde el punto de vista morfológico.
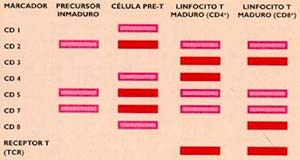
El linfocito B pasa por sucesivos estadios de diferenciación, conocidos como célula Pro-B o precursor inmaduro, célula Pre-B,linfocito B inmaduro y linfocito B maduro; este, a su vez, se diferencia en célula plasmática o plasmocito, la célula que secreta anticuerpos. Durante esos estadios aparecen diferentes moléculas en la membrana celular que constituyen indicadores (o marcadores) específicos y permiten establecer el grado de madurez de las células (Fig.1). Algunas de esas moléculas –que han podido ser identificadas mediante el uso de anticuerpos monoclonales y forman parte del grupo denominado cluster o conjuntos de diferenciación (CD) perduran durante la mayor parte de la diferenciación del linfocito, en tanto que otras son propias de ciertos estadios (véase el recuadro ‘Identificación de antígenos celulares’).

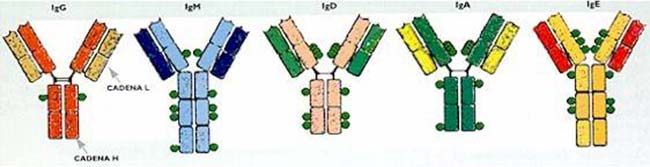
El marcador más significativo del linfocito B es la presencia en la membrana de una molécula de inmunoglobulina de la clas e M, o IgM (véase el recuadro ‘Los anticuerpos’), que reconoce e antígeno; por ello, esa IgM del linfocito B es denominada, también, receptor antigénico y tiene la misma especificidad –es decir, reconoce el mismo sitio antigénico– que el anticuerpo que será secretado luego de la estimulación de la célula por el impacto del antígeno (véanse los recuadros ‘Los receptores de los linfocitos’ y ‘La transducción de señales’).
Si células indiferenciadas, al migrar por el cuerpo, encuentran el microambiente del timo, se diferencian en linfocitos T. Los primeros cambios que sufren como parte de ese proceso de maduración ocurren en la corteza de dicho órgano, donde los linfocitos desarrollan en sus membranas (se dice también que las células expresan una molécula, cuando esta se detecta en la membrana celular) moléculas pertenecientes a los conjunt os de diferenciación (CD2, CD5 y CD7 en la figura 2). La etapa siguiente tiene lugar en la médula del timo, donde se incorporan nuevas moléculas a la superficie celular, entre ellas, las correspondientes a los CD1, CD4 y C D8. Después, el linfocito T pierde algunas de esas moléculas de superficie e incorpora otras, como las del CD3. Para entonces, las células se han diferenciado en dos grupos: el que expresa CD4 y el que expresa CD8, respectiva mente marcadores de los linfocitos Th y Tc, como lo muestra la misma figura 2. En estas etapas los linfocitos T reordenan los genes que permiten sintetizar su receptor antigénico, un heterodímero formado por dos cadenas peptídicas, a/b o g/d (vuélvase al recuadro ‘Los receptores de los linfocitos’). Cuando las células completan su maduración se vuelcan al torrente sanguíneo como linfocitos T maduros, en dos grupos definidos, los CD4+/CD8- y los CD8+/CD4-
Los linfocitos CD4+ o T colaboradores (Th) se diferencian, a su vez, en dos poblaciones funcionalmente distintas: Th1 y Th2. La primera sintetiza y libera las citoquinas denominadas interleuquina 2 e interferón g (véase el recuadro ‘Las citoquinas’) y estimula a los macrófagos a degradar bacterias y parásitos que se replican en las vesículas intracelulares (véase el recuadro ‘Los compartimentos celulares’). Los Th2, que producen las interleuquinas 4, 5 y 10, cumplen funciones regulatorias, como es la cooperación con los linfocitos B.
Los linfocitos CD8+ son los citotóxicos (Tc), que destruyen las células infectadas con, por ejemplo, virus; además de secretar interleuquina 10 e interferón g, liberan enzimas proteolíticas (así llamadas porque de gradan las proteínas) y contienen gránulos secretorios de perforina, una proteína que forma canales (por donde se escapa el material celular ) en las membranas de las células atacadas,con la consiguiente destrucción de estas.
Los linfocitos B y T que adquieren competencia inmunológica van a poblar los órganos linfoides secundarios, aunque también circulan por la sangre. Los aproximadamente mil millones de linfocitos que tiene un adulto normal, cada uno con un receptor antigénico diferente en su membrana, resultan suficientes para proteger a una persona de los agresores externos, pues se calcula que el número de antígenos existentes en la naturaleza oscila entre diez y cien millones.
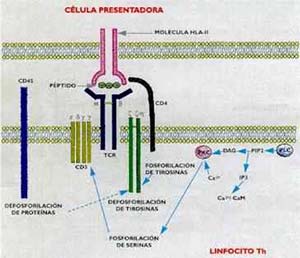
El linfocito T reconoce Pequeños péptidos de siete a quince aminoácidos (provenientes del procesado del antígeno por las células presentadoras) asociados con las moléculas HLA presentes en las membranas (véase el recuadro Los antígenos de histocompatibilidad). Cuando los antígenos son sintetizados dentro de la célula, como es el caso de las proteínas virales, los péptidos se unen con las moléculas HLA de clase I, en tanto que los antígenos de síntesis exógena (bacterias, parásitos, proteínas extrañas), previa endocitosis y procesado, son presentados al linfocito T por los HLA de clase II. La capacidad de los infocitos T maduros para reconocer el elemento restrictivo. las moléculas HLA-I o HLA-II propias no se hereda: se adquiere durante la maduración linfocitaria, por la cual los linfocitos T, por un mecanismo de doble selección positiva y negativa, aprenden a reconocer los complejos formado s por las moléculas HLA y los péptidos procedentes de la degradación de antígenos extraños, así como los complejos formados con péptidos provenientes de tejidos propios. Sólo el 5% de las células que se diferencian en el timo sobreviven y pasan a la circulación como linfocitos maduros.
Las que mueren durante el proceso de selección lo hacen por apoptosis, o muerte celular programada, inducida por señales celulares específicas (véase ‘El suicidio celular’, Ciencia Hoy, 11:43, 1991), proceso que evita que proliferen los linfocitos T que reconocen moléculas endógenas. Si el mecanismo fallara, se originaría una respuesta inmune dirigida contra los tejidos y células propios y se produciría una enfermedad autoinmune o de autoagresión.
Las células accesorias (macrófagos y células dendríticas, principalmente) tienen por función procesar los antígenos y presentar los péptidos resultantes asociados a las moléculas HLA de clase I o II, para su reconocimiento por los linfocitos Tc y Th, respectivamente.
Dichas células, especialmente los macrófagos, sintetizan y secretan diversos factores, como la interleuquina 1 y el factor de necrosis tumoral, los que actúan sobre las células inmunocompetentes. Cuando un patógeno ingresa en el organismo se activa un mecanismo de defensa que se denomina sistema de complemento. No entraremos en el detalle de este complejo sistema, pero diremos que, por ese mecanismo, las bacterias son recubiertas por ciertas proteínas que, a su vez, tienen receptores en las células fagocíticas.
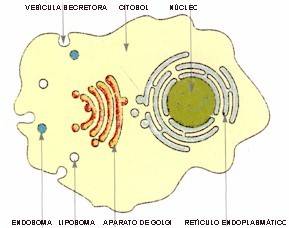
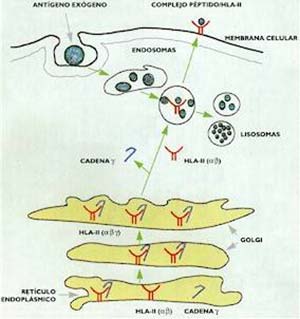
Gracias a ese ‘puente proteico’ el patógeno es incorporado (endocitado) por la célula presentadora y agregado a vesículas los endosomas cuyas enzimas inician su degradación (Fig. 3). El proceso concluye en los lisosomas, también ricos en enzimas proteolíticas, como lo menciona el recuadro ‘Los compartimentos celulares’.
Mientras tanto, en el retículo endoplásmico se realiza el ensamblado de las cadenas a y b de las moléculas HLA-II para formar el dímero a/b, al que se asocia en forma transitoria una tercera cadena peptídica (invariable o g), la que impide su unión con péptidos de origen endógeno. Cuando las moléculas HLA-II llegan al aparato de Golgi, y media una señal no identificada hasta el presente, el complejo a/b/g se dirige a los endosomas que contienen el antígeno procesado; en el camino, la cadena g se degrada y el dímero a/b puede unirse entonces con los péptidos provenientes del procesamiento del antígeno exógeno, como se muestra en la citada figura 3. Los virus se replican dentro de las células y el linfocito T debe reconocer y eliminar las células infectadas para impedir el crecimiento desproporcionado del agente infeccioso.
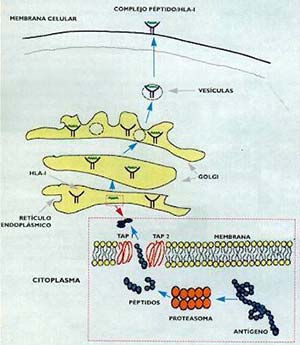
En dichas células se sintetizan las proteínas virales, extrañas y, por lo tanto, antigénicas, que son degradadas en el citosol por los proteasomas, una maquinaria enzimática formada por veintiocho subunidades (Fig. 4). Los péptidos son luego transferidos a las unidades transportadoras (o TAP, por Transporters Associated with Antigen Processing) que se encuentran en la membrana del retículo endoplásmico, las que los conducen hacia el interior de este. Una vez en el Golgi, los péptidos se unen con las moléculas HLA-I y, después, son transportados a la membrana celular para su reconocimiento por el receptor del linfocito T (véase la figura 4).
La unión del receptor del linfocito T con el complejo péptido/HLA no es suficiente para desencadenar una respuesta inmune.
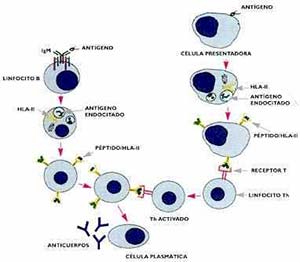
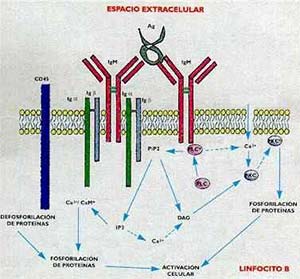
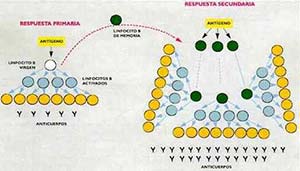
Para que ocurra se necesita que la célula presentadora de antígeno y el linfocito T se adhieran firmemente, lo que ocurre por medio de interacciones entre otras moléculas presentes en las membranas de ambas células, las denominadas moléculas de adhesión. A diferencia de los linfocitos T, los B reconocen antígenos nativos, en solución, y sin necesidad de célula presentadora o restricción HLA (consúltese nuevamente el recuadro ‘Los receptores de los linfocitos’). Sin embargo, para lograr una buena respuesta inmune humoral (o sea, para que se formen anticuerpos) se necesita la cooperación de un linfocito Th. ¿Cómo se explica lo anterior, si el linfocito T reconoce un péptido producto de la degradación antigénica y, en cambio, el receptor del linfocito B reconoce un epitope presente en el antígeno intacto? Se ha podido demostrar que el linfocito B, cuando se ha unido con el antígeno por su receptor, la IgM de membrana, lo endocita y procesa de igual manera que las células presentadoras de antígeno. En otras palabras, el linfocito B también expone en su membrana, asociados a las moléculas HLA- II, pequeños péptidos que son reconocidos por aquellos linfocitos Th que hayan aprendido a hacerlo en la membrana del macrófago (Fig. 5). Como consecuencia de la interacción de las dos células, se incrementa en el linfocito B la cantidad de receptores para interleuquina 2, la cual, sintetizada por el linfocito Th, se une a su receptor y activa la célula B, la que finalmente se diferencia en célula plasmática, productora de anticuerpos. Los hechos que acabamos de describir se ponen en marcha cuando un antígeno se hace presente por primera vez en un vertebrado inmunológicamente maduro. Es la denominada respuesta primaria. El proceso se inicia con unos pocos linfocitos que poseen receptores, los cuales, gracias a su enorme diversidad, pueden reconocer cualquier material extraño: es la selección clonal que menciona el recuadro ‘Un poco de historia’. Pero los linfocitos T y B que no se transforman en células efectoras perduran en el huésped por períodos prolongados como células con memoria inmunológica. Con un nuevo estímulo antigénico tiene lugar la denominada respuesta secundaria, por la que esas células con memoria inmunológica, que, por tener una especificidad definida (ya reconocieron una vez al antígeno) y por integrar una población más numerosa que la primera, forman anticuerpos en mayor cantidad y más rápidamente que en la respuesta primaria (Fig. 6). Este es, en esencia, el mecanismo molecular que explica el éxito de las vacunas: el individuo recibe el patógeno muerto o atenuado y establece una respuesta primaria. Cuando sobreviene la infección, las células con memoria reaccionan rápidamente y eliminan al agente agresor.
Recapitulando, el reconocimiento de un antígeno por las células inmunocompetentes pone en marcha la respuesta inmune. Cuando los linfocitos B y T interaccionan con sus ligandos específicos ocurre una serie de hechos, algunos inmediatos y otros más tardíos, que llevan a la activación de genes y a la síntesis de proteínas reguladoras (vuélvase al recuadro ‘La transducción de señales’). En los linfocitos B hay activación de los genes que permiten la síntesis de los receptores de interleuquina 2 y 4, aparición de moléculas de adhesión, fundamentales para algunas funciones, y aumento de la cantidad de moléculas HLA-II en la membrana celular, lo que facilita la presentación al linfocito T de los péptidos provenientes de la degradación del antígeno. En los linfocitos T se activan los genes de varias interleuquinas y de sus receptores. La aparición del receptor para interleuquina 2 es importante, puesto que esta citoquina, sintetizada por el mismo linfocito T, puede interactuar con su receptor y funcionar como factor de crecimiento sobre la misma célula. Lo descripto, hasta donde sabemos, ocurre durante la activación de los linfocitos B y T y permite entender cómo se pone en marcha el mecanismo, complejo pero eficiente, de la respuesta inmune