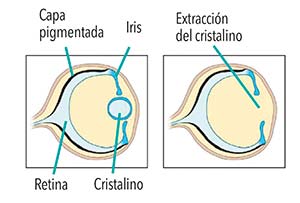
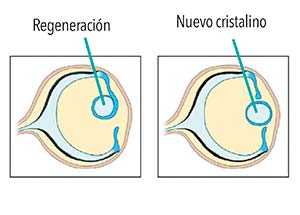
Animales que reconstruyen partes del cuerpo que han perdido por accidente o de las que se desprenden para liberarse de predadores.
Regeneración
En la mitología griega, la hidra era un monstruo acuático que vivía en el fondo del lago de Lerna y cuidaba una de las entradas al más allá. Tenía la forma de una serpiente con muchas cabezas y la capacidad de regenerar dos por cada una que perdía. Hércules la mató en uno de sus trabajos, con la ayuda de un sobrino que quemaba el cuello de cada cabeza cortada para evitar que surgieran dos en su lugar.
En realidad, los animales poseen la capacidad de reemplazar moléculas, células y tejidos como parte del mantenimiento de su cuerpo. Así, reparan tejidos sometidos a permanente desgaste, cicatrizan una herida y renuevan estructuras como la cutícula de los artrópodos, lo mismo que escamas, uñas, pelos, plumas y cuernos de los vertebrados. Sin embargo, algunos animales pueden reponer partes de órganos internos y hasta miembros completos e, incluso, reconstruir una cabeza seccionada.

En el siglo XVIII se comenzó a estudiar científicamente la regeneración de partes del cuerpo. René-Antoine Ferchault de Réaumur (1683-1757) describió e ilustró en 1712 la de las patas de un cangrejo; Lazzaro Spallanzani (1729-1799) lo hizo en 1765 con las patas de una salamandra. Charles Bonnet (1720-1793) se ocupó en 1745 de la regeneración de la cabeza en lombrices y su tío, Abraham Trembley (1710-1784), publicó en 1744 un ensayo en el que detalló sus experimentos de regeneración con un pequeño y relativamente simple animal acuático del género Hydra (que, en realidad, no tiene cabeza sino una maraña de tentáculos alrededor de la boca, semejantes a microscópicas serpientes). Solo a fines del siglo XIX se empezó a entender el fenómeno, cuando Thomas Hunt Morgan (1866-1945) demostró que unos gusanos de agua dulce llamados planarias podían reconstruir por completo su cuerpo a partir de pequeñas partes de él.
La capacidad de regeneración está ampliamente distribuida en el reino animal, aunque muestra notables variaciones. De los 34 grandes grupos de animales reconocidos actualmente, 16 pueden reconstruir su cuerpo a partir de fragmentos y 17 pueden recuperar partes amputadas. En algunos gusanos, estrellas de mar y animales que forman colonias, como los corales, la capacidad de reconstruir el cuerpo a partir de fragmentos está asociada con la posibilidad de reproducirse asexualmente: muchos pueden disociarse en dos o más partes y completar las faltantes. Los animales que reemplazan periódicamente su rígida cubierta corporal externa (llamados ecdisozoos) por lo general no regeneran su cuerpo, excepto algunos artrópodos, como los crustáceos, que reconstruyen patas u otros miembros perdidos. Los vertebrados y los demás cordados muestran pocos casos de regeneración del cuerpo, pero unos cuantos anfibios, reptiles y mamíferos son capaces de regenerar miembros externos (patas, colas), y a veces órganos internos (hígado, corazón, el cristalino del ojo). Las aves, en cambio, tienen una manifiesta incapacidad de regeneración.
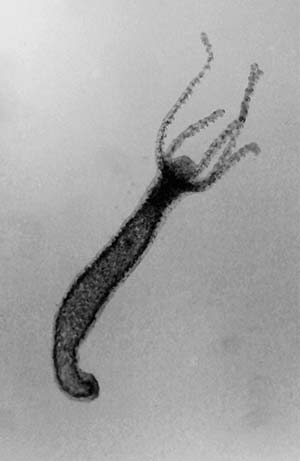
En todos los animales en que tiene lugar, la regeneración implica la diferenciación de células, a semejanza del desarrollo de un embrión. Este comienza como una sola célula, el cigoto, que se va dividiendo y va dando lugar a células diferenciadas, es decir, con distintas formas y propiedades, y con la capacidad de fabricar proteínas específicas, como las queratinas de los epitelios o la hemoglobina de los glóbulos rojos. Esas células se agrupan para formar tejidos y órganos con diferentes funciones. En otras palabras, las células del embrión tienen la potencialidad de originar casi cualquier tipo de célula del organismo: por eso, entre otros nombres, se las llama células germinales o células multipotentes (stem cells). Su potencialidad disminuye con el desarrollo, por lo que la mayoría de las células diferenciadas, si conservan la capacidad de reproducirse, solo pueden originar otras iguales a sí mismas.
Morgan reconoció en sus estudios un mecanismo de regeneración relativamente sencillo, que llamó morfalaxis, y otro más complejo, que llamó epimorfosis. El primero, típico del género Hydra, implica la diferenciación de células multipotentes que quedaron en el cuerpo del adulto, como si estuvieran de reserva, pero no la división celular. El segundo combina la diferenciación y la multiplicación de células indiferenciadas, las que forman un conglomerado llamado blastema, a partir del cual se reconstruyen todos los tejidos perdidos respetando su forma original. Un tercer mecanismo de regeneración, no previsto por Morgan, implica multiplicación celular pero no diferenciación. Se trata de la regeneración compensatoria que se observa, por ejemplo, en el hígado de los mamíferos, en la cual los distintos tipos de células diferenciadas de ese órgano se multiplican (proliferan) y completan la parte faltante.
Los fundamentos genéticos y moleculares de la diferenciación celular son los mismos en la regeneración que en el desarrollo de un embrión. Diferentes genes se expresan en distintas células como respuesta a ciertas señales constituidas por moléculas (la mayoría de las veces proteínas) producidas por alguna célula, volcadas al espacio intercelular y reconocidas por la misma u otra célula próxima o lejana. Esas señales se asocian o ligan con proteínas encontradas, principalmente, en la superficie celular: por eso se conoce a estas como ligandos y a aquellas como receptores. Una vez que el receptor recibe la señal, da a su vez inicio a una serie de reacciones químicas en el interior de la célula que activan o reprimen la actividad de genes específicos. El proceso que comienza con el reconocimiento de la señal y finaliza con la producción de una proteína se conoce como senda o camino de señalización. Distintos caminos de señalización dan lugar a diferentes asociaciones de células diferenciadas.
Gradientes morfogenéticos
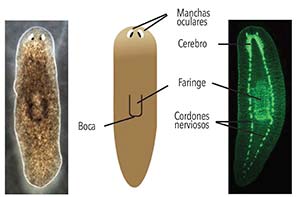
Un buen ejemplo del cometido de las señales moleculares en la regeneración es la capacidad que tiene un fragmento de planaria de generar una cabeza y una cola hacia el lado correcto, es decir, de respetar la polaridad del animal. Esto significa que la parte del fragmento más cercana a la cabeza original creará una nueva cabeza. Aunque Morgan abandonó el estudio de la regeneración en planarias porque concluyó que nunca comprenderemos el fenómeno del desarrollo y la regeneración, después de realizar amputaciones de distintas partes del cuerpo publicó una hipótesis visionaria que solo pudo ser sometida a experimento cien años después: la existencia de dos gradientes morfogenéticos opuestos.
Se dice que cuando una sustancia está muy concentrada en una región, por ejemplo en un extremo del cuerpo, y disminuye gradualmente hacia otras regiones, forma un gradiente de concentración. Si ese gradiente se asocia con la aparición de distintas estructuras en ambas regiones, se lo puede denominar gradiente morfogenético (que da origen a la forma). En 2008 se demostró que, en planarias marinas de la especie Schmidtea mediterranea, la mencionada polaridad está relacionada con el gradiente de una proteína llamada Wnt 3.

Otro organismo en el cual se ve la acción de gradientes en la regeneración de amputaciones es la Hydra, en uno de cuyos extremos tiene la boca, rodeada de tentáculos, y en otro el disco basal con el que se adhiere a plantas acuáticas u otros sustratos. Los experimentos originales de Trembley fueron refinados por Ethel Browne Harvey (1885-1965) mediante trasplantes que la llevaron a concluir que en el pequeño animal hay un gradiente activador cefálico cuyo máximo está en la zona oral, y otro activador basal cuyo máximo está en el disco basal. Sus investigaciones, publicadas en 1909, constituyen un antecedente importante –pero no del todo reconocido– para entender cómo se establecen los extremos de un animal durante el desarrollo.
Salamandras
Cada una de las extremidades de los vertebrados tetrápodos –anfibios, reptiles, aves y mamíferos– consta de varias regiones separadas por articulaciones y distribuidas a lo largo de un eje llamado próximo-distal, cuyos extremos son diferentes. La región del extremo próximo es la más cercana al cuerpo y contiene un solo hueso: húmero o fémur, según se trate de la extremidad anterior o posterior. La región siguiente incluye dos huesos: tibia y peroné o radio y cúbito. La región distal es la más alejada del cuerpo y consta de varios huesos ordenados en hasta cinco líneas que conforman muñecas y manos o tobillos y pies. Las salamandras adultas son capaces de reconstruir una extremidad completa desde el lugar en que fue seccionada, y al hacerlo respetar el orden próximo-distal y la polaridad. Así, si sufren una amputación en la rodilla, regeneran la pierna, el tobillo y el pie, pero no el muslo.
A diferencia de lo que ocurre a un mamífero cuando se lastima la piel, la herida de una salamandra solo se cubre por una capa de células epidérmicas, sin que se agregue la dermis. Inmediatamente debajo de ese capuchón epidérmico, las células de los distintos tejidos (muscular, óseo, cartilaginoso y nervioso) pierden sus características diferenciadas, lo que las hace indistinguibles entre ellas, como si hubieran regresado al estadio embrionario. Ese conjunto de células, que constituye el blastema, prolifera a partir de entonces y se produce una diferenciación de las nuevas células. Desde hace más de cincuenta años se sabe que para que ocurra la proliferación son necesarios dos requisitos: que los nervios seccionados por el accidente estén próximos al blastema y que actúen señales proteicas, que son las mismas que actúan en la diferenciación de las extremidades de los embriones. Entre ellas se encuentra el factor de crecimiento fibroblástico 10 o FGF10, producido por las células de un conglomerado celular embrionario llamado mesénquima.

¿Qué determina que las células del blastema fabriquen un brazo, un antebrazo o una mano? El responsable es un grupo de genes regulatorios, llamados genes homeóticos o HOX, cuyas mutaciones generan monstruos con estructuras fuera de su lugar normal. La expresión de esos genes está controlada por una molécula relativamente pequeña, el ácido retinoico. La epidermis que cubre la amputación de un miembro de salamandra produce ácido retinoico; se forma en consecuencia un gradiente morfogenético a lo largo del eje próximo-distal que disminuye hacia la base. La aparición de ácido retinoico en un lugar inapropiado conduce a una pata con alguna parte duplicada.
Como, además, cada extremidad tiene un lado dorsal y otro ventral (la palma de la mano, por ejemplo), y un lado anterior y otro posterior (pulgar y meñique), la expresión genética correcta es consecuencia de la actividad de otros genes regulatorios, que también son los que actúan en el desarrollo normal del embrión.
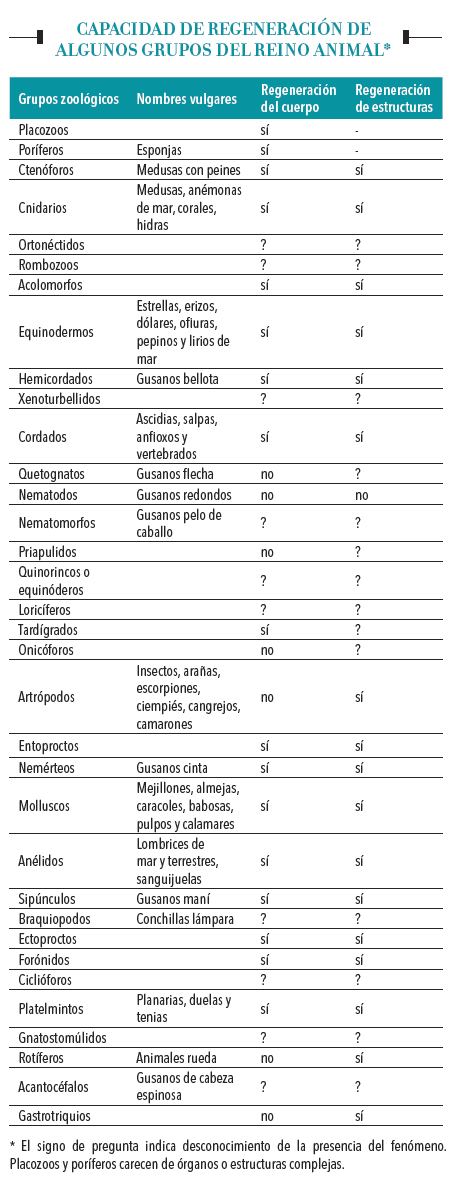
Cangrejos
En el medio local es difícil conseguir salamandras, salvo en negocios que venden mascotas exóticas. En cambio, es fácil encontrar cangrejos, tanto en las costas de ríos o lagunas como del mar. El crecimiento de estos animales es discontinuo e incluye la degradación de la cubierta corporal o cutícula al tiempo que, por debajo de ella, fabrican otra más grande. Cada tanto, el cangrejo sale de la vieja cutícula y se expande, un proceso que se llama muda o ecdisis y no es exclusivo de los cangrejos: todos los artrópodos, así como otros animales, crecen de esta forma.
Las patas y las pinzas de los cangrejos pueden perderse como consecuencia de una lastimadura o del ataque de un predador, pero el animal puede regenerarlos luego de una o dos mudas; al cabo de varias mudas, alcanzan el mismo tamaño del apéndice contralateral (su simétrico del otro lado del cuerpo). En realidad, en los artrópodos la pérdida de un apéndice es una autoamputación programada que tiene lugar en un sitio predeterminado, lo que les asegura una muy escasa pérdida de fluidos corporales.
En los cangrejos la regeneración tiene lugar en dos fases. La primera ocurre inmediatamente después de la autoamputación y de la cicatrización del extremo subsistente del apéndice, de modo independiente del tiempo faltante para la próxima muda. Esa fase se llama de crecimiento basal e incluye la formación de un blastema bajo el plano de autoamputación y el comienzo de la morfogénesis. Luego el blastema se diferencia en una pata o pinza completa, en miniatura, bajo una cutícula flexible, es decir, forma un muñón de regeneración. La segunda fase es un período breve que antecede a la muda y se completa al suceder esta, cuando el nuevo apéndice, más pequeño que su simétrico, sale del muñón. La fase se llama de crecimiento preecdisial y durante ella los tejidos se hipertrofian e incrementan hasta tres veces el tamaño del apéndice en crecimiento, no por aumento del número de células sino por producción de proteínas e hidratación. Si la autoamputación ocurrió poco antes de una muda, no deja tiempo para el crecimiento basal del muñón y habrá que esperar hasta la próxima muda para completar el apéndice.
La regeneración está finamente coordinada con la muda, en especial por el efecto de la ecdisoma, la hormona que la regula. Como la frecuencia de mudas disminuye con la edad, es mucho más fácil de observar la presencia de muñones o apéndices recientemente regenerados en cangrejos jóvenes y pequeños.
Mamíferos
En el siglo XVIII, Voltaire expresó su asombro ante la capacidad de algunos caracoles de regenerar sus cabezas, y su esperanza de que una capacidad semejante existiese en los humanos. Poco después tuvo lugar la Revolución Francesa, pero Luis XVI, María Antonieta, Danton o Robespierre, entre tantos otros, no pudieron beneficiarse de un fenómeno semejante. La realidad es que la regeneración de apéndices o de partes mayores del cuerpo es bastante escasa en los mamíferos, aunque algunos órganos internos, como el hígado, pueden reconstruirse parcialmente y el corazón de los ratones puede generar nuevas células cardíacas luego de una lesión del miocardio.
Un caso muy particular es el de dos especies de ratones espinosos de África del género Acomys, cuya piel se desprende fácilmente hasta en un 60% de su superficie, habilidad que les permite escapar de sus predadores y dejarles solo una pequeña parte de su cuerpo, algo similar a lo que ocurre con la cola de ciertos lagartos y las patas de cangrejos. En los ratones comunes de laboratorio (Mus musculus) se forma una cicatriz cuando se remueve porciones de su piel, pero los mencionados Acomys recuperan por completo piel, folículos pilosos, glándulas sudoríparas e incluso cartílago. De ningún otro mamífero se conoce, hasta el momento, una capacidad semejante.
Muchos mamíferos (incluso los humanos) pueden regenerar el extremo de sus dedos si subsiste parte de las uñas, específicamente parte del tejido epitelial que les subyace. Si bien ese proceso se conoce desde hace cuarenta años, solo hace poco se descubrió que comparte varias características con los que tienen lugar en planarias, cangrejos o salamandras, entre ellas la señal Wnt y la proteína FGF, así como la necesaria presencia de nervios cerca de la parte seccionada.
Si bien la capacidad de regeneración que hemos descripto generalmente se consideró una propiedad muy antigua en la evolución de los animales, dada su presencia en diversos grupos y la uniformidad de los mecanismos que la posibilitan, un reciente estudio del genoma de la salamandra Notophthalmus viridescens sugirió que la adquirió en tiempos evolutivos relativamente recientes, y que no la comparte por otros animales. Sobre un total estimado de unos 15.000 genes que codifican proteínas en esa salamandra, 826 son exclusivos de la especie y varios de estos se expresan con distinto nivel en tejidos regenerados y normales. Una conclusión arriesgada que se podría sacar de este descubrimiento es que algún día llegaría a ser posible despertar la capacidad de regeneración en los mamíferos, incluido el ser humano. Sin embargo, las esperanzas de activar en este la regeneración de brazos y piernas parecen, a decir verdad, más bien débiles.
De todas maneras, el descubrimiento de procesos regenerativos en animales lejana o cercanamente emparentados con los humanos y su utilización como modelos experimentales para comprender los mecanismos de esos procesos permiten ser más optimistas sobre el desarrollo de algunas terapias que permitan compensar estructuras parcialmente dañadas.
Doctor en ciencias biológicas, UBA.
Investigador principal jubilado, Conicet.
Profesor titular jubilado, UNMDP.







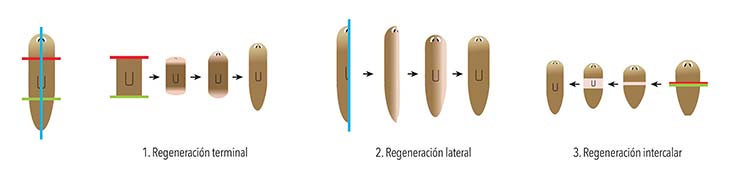 Las planarias pueden completar su cuerpo si eliminamos: (1) cabeza y cola; (2) un lado completo, y (3) la parte media. Las líneas de colores indican los respectivos cortes, algunos de los muchos que pueden hacerse con igual resultado. Adaptado de Adell T, Cebrià F y Saló E, 2010, ‘Gradients in Planarian Regeneration and Homeostasis’, Cold Spring Harbor Perspectives in Biology, doi:10.1101/cshperspect.a000505.
Las planarias pueden completar su cuerpo si eliminamos: (1) cabeza y cola; (2) un lado completo, y (3) la parte media. Las líneas de colores indican los respectivos cortes, algunos de los muchos que pueden hacerse con igual resultado. Adaptado de Adell T, Cebrià F y Saló E, 2010, ‘Gradients in Planarian Regeneration and Homeostasis’, Cold Spring Harbor Perspectives in Biology, doi:10.1101/cshperspect.a000505. Regeneración del brazo de una estrella de mar.
Regeneración del brazo de una estrella de mar.