En nuestro país, al igual que en el resto del mundo, todavía no se aprovecha convenientemente el denominado suero del queso, que es el residuo líquido que queda luego de coagular la leche con emzimas específicas. El suero del queso contiene proteinas muy valiosas para la industria alimentaria y farmacéutica. Puesto que la producción de quesos a nivel mundial origina cantidad tal de suero que equivale a 660.000 toneladas anuales de estas proteínas, es importante estudiar cómo separarlas, purificarlas y utilizarlas.
El residuo líquido que queda después de la fabricación del queso contiene proteínas de alto valor nutritivo. Su adecuado aprovechamiento puede dar lugar a productos útiles de gran valor agregado.
Luego de obtenerse el sólido que llamamos queso a partir de la coagulación de la leche, queda un residuo líquido, el denominado suero del queso (véase el recuadro “Leche, queso y ricotta”). Es este un efluente industrial rico en proteínas –contiene 6g de ellas por cada litro- que en la Argentina, como sucede en el resto del mundo, todavía no se aprovecha en forma eficiente. Este hecho, que en nuestro léxico biotecnológico denominamos la valorización del suero del queso, es un problema que ocupa a muchos investigadores.
Pero comencemos por el principio, o sea por la materia prima, la leche. Si observamos la Tabla 1 nos enteramos de que la leche contiene diversas proteínas, de las cuales las caseínas son las más abundantes, ya que representan el 80% de las proteínas totales. Las caseínas de la leche tienen pesos moleculares que oscilan entre 25.000 y 40.000; las más importantes son la a , la b y la k , que representan, respectivamente, el 50, 30 y 15% del total de las caseínas. En la leche, estas proteínas se asocian entre si para formar pequeñas partículas denominadas micelas, que se encuentran estabilizadas gracias a la presencia de la caseína k . Cuando se va a fabricar queso, se agregan a la leche enzimas coagulantes, las que catalizan la ruptura de un solo enlace peptídico de la k -caseína: la unión entre el aminoácido fenilalanina en la posición 105 y la metionina en la 106 (véase el recuadro “La estructura de las proteínas”, Ciencia Hoy 29:32-35, 1995). Este clivaje de la k -caseína provoca la desestabilización de las micelas y por lo tanto la precipitación de casi todas las caseínas, las que posteriormente se van a transformar en queso.

Aproximadamente, la cantidad de suero residual es 5 a 10 veces mayor que la de queso producido. Se calcula que en Europa se producen 75 millones de toneladas anuales de suero de queso, 27 en América del norte y 8 en otras áreas del mundo, lo que resulta en un total de 110 millones de toneladas. Como ya dijimos que la concentración de proteínas en el suero del queso es de 6g/l, esto equivale a 660.000 toneladas anuales de proteínas, lo cual justifica el interés que despiertan. No existen referencias sobre la cantidad de suero que se produce en nuestro país, pero este valor debe ser elevado, ya que somos importantes productores de queso.
Pero examinemos ahora la calidad de estas proteínas, la cual está relacionada con dos de sus propiedades, las funcionales y las nutricionales. Las propiedades funcionales son las que confieren a los alimentos características distintivas de apariencia, textura, sabor, etc., mientras que las nutricionales son las que están determinadas por la composición en aminoácidos de las proteínas.
Las proteínas del suero del queso tienen excelentes propiedades funcionales y un valor nutritivo muy alto debido a su excepcional contenido en lisina, triptofano y aminoácidos azufrados. A pesar de estas cualidades, durante muchos años las proteínas del suero no se usaron para consumo humano, sino que sirvieron de alimento para porcinos, fueron eliminadas por las cloacas y los ríos, o se dispersaron sobre los campos por lo que así provocaron una importante contaminación del medio ambiente. Se ha calculado que el efecto contaminante de 1.000 litros de suero del queso es equivalente al que producirían 400 personas.
En nuestro país se utiliza el suero del queso para preparar ricotta, precipitando las proteínas por calentamiento en medio ácido (véase el recuadro “Leche, queso y ricotta”). En este procedimiento se aprovechan solamente las propiedades nutricionales de las proteínas, ya que el procedimiento las desnaturaliza, es decir que las proteínas se despliegan, pierden su estructura y por lo tanto también sus propiedades funcionales.
A comienzos de la década del setenta comenzó a desarrollarse la tecnología de ultrafiltración por membrana, que permite retener las proteínas de una solución en una membrana que posee poros muy pequeños. Así, tanto en Europa como en los EE.UU. los investigadores pudieron analizar la factibilidad de preparar productos derivados de las proteínas del suero del queso, respondiendo a las necesidades de las industrias farmacéutica y de la alimentación. Por la simple filtración del suero quedan retenidos por la membrana, los WPC (por whey protein concentrates), que pueden contener desde un 15 hasta un 85% de proteínas. Recordemos que el proceso de ultrafiltración no desnaturaliza las proteínas del suero, por lo que en los WPC sus propiedades funcionales permanecen intactas.
Pero comenzaron las dificultades. Las membranas se taponaban debido a las partículas que quedan suspendidas en el suero y a las fosfolipoproteínas -proteínas unidas a lípidos y fósforo- que quedaban retenidas. Esto producía, por un lado, una disminución en el flujo de filtración y, por el otro, la pérdida en la capacidad de formar espuma de los WPC, ya que las fosfolipoproteínas inhiben esta propiedad.
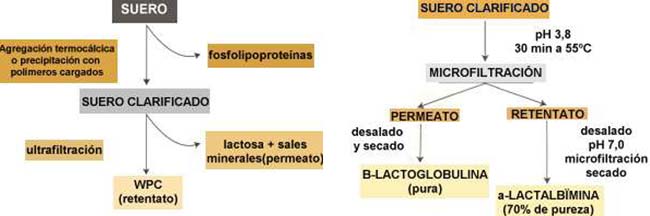
En 1985 el grupo francés dirigido por J. L. Maubois desarrolló un proceso que permite precipitar y separar las fosfolipoproteínas, lo cual deja un suero claro que no tapona los filtros (Figura 1). Esto se logra simplemente agregando calcio al suero hasta una concentración de 1,2g/kg, ajustando el pH a 7,3 y variando rápidamente la temperatura de 2 a 500C. Nuestro grupo de trabajo desarrolló un método alternativo para la clarificación del suero, que se basa en la precipitación de las fosfolipoproteínas mediante el uso de polímeros cargados.
Es decir que el primer paso del procesamiento del suero del queso es su clarificación por eliminación de las fosfolipoproteínas. Estas no se desechan, ya que son útiles por sus propiedades funcionales; por ejemplo, puesto que retienen agua, se utilizan en la preparación de hamburguesas, ya que no permiten que estas se sequen. El paso siguiente consiste en proceder a la ultrafiltración, pero ahora sin temor a que se tapen las membranas; las proteínas quedan retenidas y pasan los componentes de bajo peso molecular, de manera que se obtiene un liquido filtrado -denominado permeato- rico en sales y en el azúcar lactosa, y un líquido que no pasa a través de la membrana de ultrafiltración -lo llamaremos retentato- que es el WPC del que ya hablamos (Figura 1).
Gracias a sus propiedades funcionales -viscosidad y capacidad de formar espuma- los WPC se utilizan en la industria alimentaria como sustitutos de la clara de huevo; se emplean, por ejemplo, en la elaboración de merengues y mousse. Debido a sus propiedades nutricionales, también sirven como suplemento proteico, ya que contienen una proporción importante de aminoácidos esenciales, es decir, aquellos aminoácidos que no son producidos por el organismo y por lo tanto deben ser aportados por la dieta. Las proteínas presentes en los WPC son mejores que las del propio queso, las de soja y muchas otras; se las puede usar en galletitas, fideos, salsas, bebidas, etc.
Para determinar si los aminoácidos de las proteínas son aprovechables por el organismo, se usan pruebas de alimentación en ratas; el valor nutricional de una proteína se puede expresar como relación de eficiencia proteica, que es la ganancia de peso por gramo de proteína absorbida por el organismo. En el caso de la caseína este valor es de 2,5; para las proteínas de la leche se obtiene una relación de eficiencia de 3,1; y para las proteínas del suero del queso, 3,5. Utilizando valores como los anteriores se puede entonces extrapolar que para cubrir los requerimientos promedio diarios de aminoácidos, un individuo de 70kg debería consumir 28,4g de proteínas de leche pero solamente 14,5g de proteínas del suero del queso.
Pero la historia no termina aquí, ya que desde hace unos pocos años, se puede seguir adelante en la valorización del suero del queso, utilizando distintos caminos. El primero, y al mismo tiempo el más simple, es separar y purificar las dos proteínas que están en mayor proporción en el suero, la a -lactalbúmina y la b -lactoglobulina, que representan el 17 y el 42% del total de las proteínas del suero, respectivamente (Tabla 1).
Tabla 1
Composición proteica de las leches de vaca y humana
Proteína Leche de vaca (g/100ml) Leche humana (g/100ml)
Caseína 2,80 0,25
a -lactalbúmina 0,12 0,25
b -lactoglobulina 0,30 No contiene
Inmunoglobulinas 0,05 0,10
Lactoferrina 0,02 0,17
Lactoperoxidasa 0,003 No contiene
Totales 3,40 0,89
Existen muchas formas de separar estas dos proteínas en el laboratorio, pero a escala industrial las posibilidades se reducen considerablemente debido, sobre todo, al factor costo. En 1987 el equipo de J. L. Maubois desarrolló en Francia un método industrial de separación basado en que en medio ácido -pH 3,8- la a -lactalbúmina se agrega -o polimenriza- y forma un precipitado si se calienta ligeramente. Esta agregación es totalmente reversible: la proteína se redisuelve cuando la temperatura y el pH vuelven a sus valores originales (Figura 2).
Nos preguntamos ahora por qué conviene separar estas dos proteínas. La respuesta es: porque puede obtenerse mayor rendimiento económico a partir de las proteínas separadas que juntas. Un estudio hecho en Australia en 1987 compara las ganancias obtenidas si se concentran las proteínas para obtener un WPC 35 -es decir, un concentrado de proteínas del suero del queso que contiene 35% de proteínas respecto de los sólidos totales- con las que se obtienen separando a -lactalbúmina de b -lactoglobulina (Tabla 2). Las cifras son claras: las proteínas separadas valen unas diez veces más que el WPC. Una de las explicaciones la encontramos en la fabricación de alimentos para lactantes, que tratan de acercarse a la composición de la leche de origen humano. Veamos en la Tabla 1 las diferencias cuali y cuantitativas entre las leches de vaca y humana:
* la concentración de proteínas totales es mucho menor en la leche humana que en la de vaca. Cuando una madre joven no tiene leche para amamantar a su hijo y le pregunta a alguien con experiencia, se le recomienda que alimente al bebé con leche de vaca, pero no pura, porque es muy “pesada”, sino rebajada con agua. Esa persona “sabe” que la concentración de proteínas es mayor en la leche de vaca que en la humana y que, por lo tanto, para tornarla semejante hay que diluiría;

* la leche humana contiene mucha menos caseína -30% del total de proteínas- que la de vaca (más del 80%);
* la leche de madre no contiene b-lactoglobulina, pero la concentración de a -lactalbúmina es mayor que en la leche bovina;
* la leche humana tiene mucha lactoferrina y la de vaca muy poca.
Observando estas diferencias podemos inferir que se puede fabricar una leche “humanizada” si mezclamos proporciones convenientes de a -lactalbúmina, caseína y permeato del suero del queso. Esta utilización ya justifica la separación de la a -lactalbúmina de b -lactoglobulina, aunque existen otras razones para hacerlo, las que surgen de la lectura del recuadro “Utilización de la a -lactalbúmina y la b -lactoglobulina en la industria farmacéutica y alimentaria”.
Pero, además, en el suero del queso hay otras proteínas que, si bien están en una proporción bastante inferior, representan posibilidades económicamente importantes debido a su alto valor agregado. Son fundamentalmente tres: la lactoferrina, la lactoperoxidasa y las inmunoglobulinas, que por tener un peso molecular elevado quedan concentradas en la misma proporción que la a -lactalbúmina y la b -lactoglobulina cuando se preparan los WPC.
La lactoferrina, que es el componente que le falta a la “leche humanizada” (Tabla 1), se encuentra en la saliva, la leche, secreciones vaginales y bronquiales, y en los gránulos de los neutrófilos -una de las clases de células blancas de la sangre-. Sus propiedades biológicas comprenden la regulación de la absorción de hierro y otros metales en el tracto gastroduodenal, la modulación de la producción y del crecimiento de algunas células animales, y la actividad antimicrobiana contra bacterias y hongos. Recientemente se ha descubierto que por clivaje de la lactoferrina con una enzima se obtiene un pequeño fragmento que ha sido denominado lactoferricina, el cual posee una actividad antimicrobiana 10 a 100 veces mayor que la lactoferrina que le dio origen.
Tabla 2
Rendimiento económico comparativo del WPC y de a -lactalbúmina y la b -lactoglobulina separadas
(valores expresados en u$s)
Dato WPC 35 a -lactalbúmina y b -lactoglobulina
Costo de manufactura 4.360 4.960
Beneficio 4.850 9.340
Beneficio diario neto 490 4.380
Beneficio neto por año (200 días) 98.000 876.000
Los valores están calculados para el procesamiento de 400.000 litros diarios de suero. WPC 35 es un concentrado de proteínas del suero del queso que contiene 35% de proteínas respecto de los sólidos totales.
A partir de 1987 aparecieron varias patentes de purificación de estas proteínas, y desde 1988 ya se comercializan en Europa. Su purificación a partir de WPC es similar en todos los métodos descriptos: se basa en adsorberLas sobre resinas de intercambio iónico y luego eluirlas selectivamente -es decir, separarlas de la matriz- con soluciones salinas de diferentes concentraciones.
Otro subproducto importante del aprovechamiento de las proteínas del suero del queso es el permeato de la ultrafiltración, rico en lactosa y sales minerales (Figura 1). Puede usarse para obtener lactosa, reconstituir leche humana mezclándolo con caseína, a -lactalbúmina y lactoferrina, o como medio de cultivo en procesos de fermentación para la producción de alcohol, vino blanco, levadura y ácidos orgánicos.
Frente a todas estas posibilidades, ¿qué hacemos en la Argentina? Desde hace cinco años, nuestro grupo de trabajo estudia la purificación de lactoferrina y lactoperoxidasa por métodos que se diferencian de los utilizados corrientemente. La estrategia de trabajo consiste en “atrapar” una proteína adsorbiéndola a un soporte o matriz cromatográfica que, a su vez, lleva unida una molécula -o ligando- que tiene afinidad por dicha proteína. La cantidad de material que va a quedar retenido en la matriz depende de dos factores: su concentración en la solución original y sus características de interacción con el ligando presente en la matriz cromatográfica. Esta interacción está caracterizada por lo que se llama la constante de disociación de la proteína con el ligando inmovilizado en la matriz. Para que la captura de la proteína sea eficiente, su concentración debe ser por lo menos 10 veces mayor que el valor de la constante de disociación.
En la cromatografía de intercambio iónico -como su nombre lo indica- las proteínas quedan retenidas por una interacción electrostática entre el ligando, que posee carga eléctrica neta, positiva o negativa, y la proteína cuya carga es de signo contrario. En la cromatografía de afinidad, en cambio, las proteínas son atrapadas por ligandos inmovilizados merced a una multiplicidad de interacciones, de manera tal que la interacción es mucho más intensa y por lo tanto la constante de disociación menor que en el caso del intercambio iónico. Es decir que si se quiere retener una proteína que está en baja concentración, como es el caso del suero del queso, la cromatografía de afinidad resulta la opción más apropiada. Este procedimiento permite partir del suero original, por lo que así evita la complicación de obtener primero un WPC.
Cuando se habla de cromatografía de afinidad, normalmente se piensa en utilizar como ligando un anticuerpo, pero este tipo de cromatografía, llamada bioespecífica, resulta muy cara; está reservada para proteínas de alto valor comercial. Sin embargo, existe otro tipo de cromatografía de afinidad que utiliza ligandos sintéticos: es la cromatografía de afinidad pseudobioespecífica. Ligandos típicos de este tipo de cromatografía son los metales inmovilizados (véase “Jugos de fruta sin metanol”, en Ciencia Hoy 33: 25-32, 1996) y los colorantes triazínicos, que son aquellos que usa la industria textil para teñir las telas.
Los colorantes triazínicos son baratos y resistentes a la degradación química y biológica; recordemos que una matriz cromatográfica que se use industrialmente debe tener una larga vida útil. Como hay muchísimos colorantes triazínicos, y puesto que cada uno de ellos mostrará una constante de asociación distinta con una determinada proteína, debimos elegir cuál resultaba más adecuado a nuestros fines. Resultó ser el Rojo HE-3B. Luego de inmovilizarlo sobre un soporte cromatográfico, conseguimos establecer condiciones experimentales en las que este ligando podía retener el 95% de la lactoferrina presente en el suero del queso y prácticamente nada del resto de las proteínas. Luego, agregando simplemente una determinada concentración de sal, que debilita la unión de la proteína al ligando, se separa la lactoferrina del soporte.
Creemos que esta metodología -desarrollada en la Universidad de Buenos Aires- puede resultar de interés para valorizar el suero del queso, un subproducto industrial que, como dijimos al principio, todavía se utiliza como alimento para los cerdos.












