Un recorrido por las enfermedades virales que hoy nos preocupan, tanto las nuevas como las antiguas.
Enfermedades virales emergentes: ¿nuevos virus?, ¿antiguos agentes patógenos que sólo ahora han sido identificados?
En los últimos tiempos se han identificado muchos virus hasta entonces desconocidos. Si bien algunos no parecen afectar a seres humanos o animales, habitualmente la identificación de un virus nuevo–o virus emergente– ha sido consecuencia de la aparición de determinada enfermedad. Sin embargo, no todas las enfermedades virales emergentes son nuevas, pues algunas han afectado de modo considerable a la sociedad a lo largo de la historia, pero sólo en épocas recientes el avance científico permitió asociar una dolencia con su virus. En la tabla 1 se dan ejemplos de enfermedades virales que, seguramente, resultarán familiares para el lector. Algunas aparecieron hace siglos, fueron en parte controladas y han vuelto a emerger; estas últimas –entre las que se cuentan la fiebre amarilla, el dengue y la influenza– se designan, de manera más apropiada, reemergentes.
La primera descripción de la fiebre amarilla se encontró en un manuscrito maya del siglo XVII; en los albores del siglo XX, se demostró por primera vez que un agente filtrable (véase el recuadro ‘Los virus y su identificación’), transmitido por un mosquito –denominado vector–, causaba la enfermedad. Es muy probable que, en sus orígenes, la fiebre amarilla haya estado confinada a las selvas tropicales, donde tenía lugar un ciclo de infección por el que el mosquito, después de alimentarse con la sangre de monos infectados, transmitía el virus al picar a otros monos. El hombre pudo haber enfermado de fiebre amarilla cuando, circunstancialmente, se interpuso en este ciclo natural y fue picado por un mosquito infectado. Así, la fiebre amarilla habría sido, en sus comienzos, una zoonosis, término con el que se designa a las infecciones de animales que son transmitidas al hombre. Se cree que el tráfico de esclavos y el comercio marítimo contribuyeron a diseminar el virus causante de esta enfermedad –así como uno de sus vectores, el mosquito Aëdes aegypti– desde el África a otras áreas tropicales. El Aëdes aegypti se adapta bien a las ciudades, lo que determinó la aparición de epidemias de fiebre amarilla urbana. Se creó así un nuevo ciclo de infección, por transmisión interhumana realizada por mosquitos infectados.
El dengue fue descripto por primera vez a fines del siglo XVIII; como la fiebre amarilla, se caracteriza por ciclos de infección en los que intervienen, el hombre, los mosquitos y otros animales. Se expandió enormemente durante la segunda guerra mundial, como consecuencia del acantonamiento de tropas con individuos infectados en zonas del Pacífico y Asia. Actualmente se infectan unos 80 millones de personas por año en las áreas tropicales; se calcula que otros 2000 millones corren el riesgo de contraer la enfermedad. Los virus causantes del dengue son transmitidos por el mismo mosquito que propaga la fiebre amarilla. En los años ochenta, un nuevo vector, el Aëdes albopictus, llegó al África y las Américas desde Asia, su lugar de origen, en cubiertas viejas, importadas para ser recapadas, las que habían estado a la intemperie antes del embarque y tenían pequeñas acumulaciones de agua de lluvia, donde los mosquitos habían depositado huevos. En los Aëdes albopictus se han detectado recientemente virus autóctonos de América, por lo que no sería sorprendente que este mosquito pudiera contribuir a la emergencia de nuevas enfermedades.
Los ejemplos anteriores ilustran de qué forma la actividad humana –desplazamiento de poblaciones, guerras, urbanización, comercio– puede influir en que emerjan y reemerjan enfermedades virales. Si se tiene en cuenta que en los últimos cincuenta años hubo un marcado aumento de la población mundial y una enorme disminución del tiempo necesario para cubrir grandes distancias, y que la manipulación del ambiente por el hombre alcanzó niveles hasta ahora desconocidos, no es sorprendente que, en la segunda mitad del siglo XX, se haya acelerado la aparición de nuevas enfermedades virales.
Una pregunta usual en discusiones sobre la aparición de nuevos virus se refiere a la importancia relativa de los cambios en el material genético de los virus, es decir, las mutaciones (véase el recuadro ‘Los virus y su identificación’), en contraposición con la transferencia de virus existentes a un nuevo hospedador –también llamado huésped–. Esto último se denomina tráfico viral. En realidad, son pocos los ejemplos bien documentados en los que la aparición o reaparición de una enfermedad viral sea el resultado de cambios en el material genético del virus. La influenza, probablemente, sea la mejor muestra de una patología en la que la continua evolución del virus es responsable de epidemias anuales y, ocasionalmente, de pandemias como la acaecida en 1918, que produjo más de 25 millones de muertes. La aparición en los años setenta de un nuevo patógeno de perros, el parvovirus canino, es un ejemplo de cambios en el material genético del virus asociados con tráfico viral: unas pocas mutaciones en genes estratégicos de un virus de los gatos lo transformó en un patógeno transmisible entre perros. Hoy el virus continúa evolucionando en todo el mundo en su nuevo huésped. Algo similar debe de haber ocurrido con la aparición del sida. La información disponible lleva a pensar que el virus de la inmunodeficiencia humana (VIH o, en inglés, HIV) evolucionó en primates y luego pasó a un nuevo huésped, el hombre (véase ‘El pasado del HIV’, Ciencia Hoy, 37:54-59). El largo tiempo de incubación de la enfermedad y la persistencia de la infección fueron factores determinantes de la gran diseminación del virus.
En la mayoría de las enfermedades emergentes más recientes, los respectivos virus parecen haber existido por mucho tiempo en la naturaleza, bien establecidos en sus hospedadores habituales. El aumento de la población mundial, que llevó al asentamiento humano en zonas antes deshabitadas, y actividades como la agricultura y la deforestación, entre otros factores, hicieron más probable el contacto entre hombres y animales infectados y, por lo tanto, promovieron el tráfico viral. Si una enfermedad que emerge concluye rápidamente, las víctimas no tienen demasiado tiempo de infectar a otros antes de sanar o morir; en estos casos, la enfermedad toma la forma de brotes más o menos localizados. Las fiebres hemorrágicas producidas por arenavirus y hantavirus que surgieron en los últimos años constituyen ejemplos de tal tipo de enfermedad. Los virus mencionados se hospedan en determinadas especies de ratones, a los que no parecen afectar y que constituyen su reservorio natural (Figs. 1 y 2).
La fiebre hemorrágica argentina emergió en los años cuarenta en las llanuras del noroeste de Buenos Aires. El cultivo de grandes áreas de maíz permitió la proliferación de poblaciones de ratones e incrementó la posibilidad de contactos entre el hombre y los roedores portadores del patógeno. Después de un brote severo de dicha fiebre, en 1958 se aisló el virus causante de la enfermedad. Se lo llamó virus Junín y pertenece a la familia Arenaviridae (Tabla 1). Otros arenavirus asociados con fiebres hemorrágicas en Sudamérica son el Machupo, responsable de la fiebre hemorrágica boliviana, que emergió en aldeas de un alto valle en Bolivia en los años sesenta y produjo brotes posteriores en los años setenta y en 1994, y el virus Guanarito, el que, desde su aparición en 1991, fue responsable de varios brotes en zonas tropicales de Venezuela.
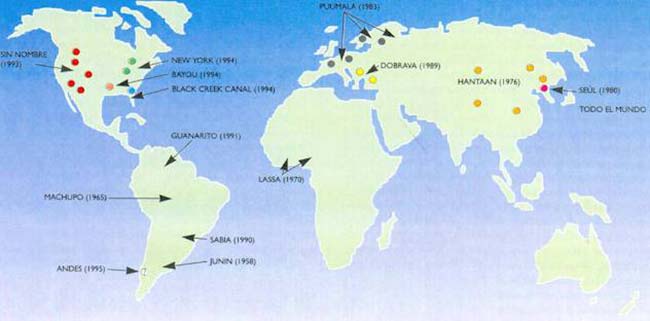
Otro peligroso virus que alcanzó las primeras planas de los diarios en los últimos tiempos es el Ébola, identificado en 1976 y responsable de varios brotes de fiebres hemorrágicas en diversos países del África. Su diseminación fue consecuencia de la poca higiene en los hospitales, y también de prácticas locales de inhumación que requieren la remoción manual de las vísceras del cadáver. Aún no se conoce el huésped que permite al virus Ébola sobrevivir en la selva, pero puede suponerse que no es el mono, pues este enferma y muere rápidamente por acción del virus.
De los ejemplos expuestos se deduce que han surgido muchas enfermedades virales a lo largo de la historia, pero que en los últimos años su aparición parece haberse acelerado. Es necesario tener en cuenta que algunas de las llamadas ‘nuevas enfermedades emergentes’, principalmente las que afectan a pocos individuos y en lugares remotos, pueden haber existido desde muy antiguo, pero han pasado inadvertidas. También se debe considerar que el avance tecnológico ha permitido acortar el tiempo transcurrido entre la descripción de la enfermedad y la identificación del virus, que fue de cientos de años en el caso de la fiebre amarilla y sólo de pocas semanas en el del SPH.
Actualmente, sabemos que la emergencia de una nueva enfermedad viral es el resultado de la interacción, generalmente compleja, de distintos elementos, entre los que se incluyen cambios climáticos, actividad humana y determinantes virológicos. Hay consenso en que no existe forma de predecir cuándo emergerá una nueva enfermedad viral, pero lo hay igualmente acerca de que se pueden reducir sus riesgos mediante vigilancia sanitaria y una rápida identificación del peligro
Los virus y su identificación
¿Qué es un virus? A mediados del siglo pasado, cuando se conocían las bacterias y habían sido observadas al microscopio, hubo científicos que obtuvieron suficientes evidencias como para postular que debían existir agentes infecciosos demasiado pequeños para ser vistos por los microscopios de entonces. Años después, investigadores que estudiaban una enfermedad de la planta del tabaco encontraron que los extractos de las hojas de las plantas enfermas transmitían la enfermedad a las sanas. Tales extractos contenían un agente infeccioso que no podía ser visto al microscopio y que pasaba por los filtros usados para retener las bacterias. Por eso, la primera definición operacional de virus fue agente infeccioso filtrable.
Los virus no sólo son distintos de las bacterias por su tamaño. A diferencia de estas, que son capaces de utilizar los nutrientes del medio en el que son cultivadas, transformarlos y usarlos para su reproducción, los virus son seres vivos a medias: deben alojarse en células, las que los proveen de los materiales y la maquinaria necesarios para su supervivencia.
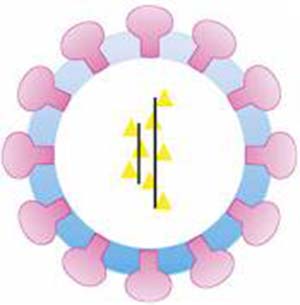
El avance científico y tecnológico permitió conocer la composición de la mayoría de los virus y, en muchos casos, su forma de multiplicación. También se los puede ver hoy a través de microscopios especiales. Se puede decir que los virus consisten en una capa de proteínas, que en ciertos virus incluye algo de lípidos, y un poco de material genético, ya sea ácido ribonucleico (ARN) o desoxirribonucleico (ADN) (véase ‘ADN, una molécula maravillosa’, Ciencia Hoy, 8:26). El material genético de los virus contiene la información necesaria para fabricar nuevos virus, pero no la de cómo hacer el trabajo. La figura I muestra una representación esquemática de un arenavirus, cuyo material genético está constituido por dos segmentos de ARN.
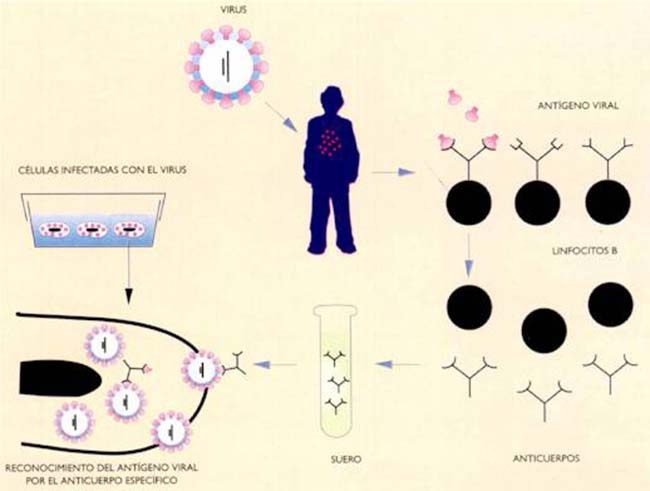
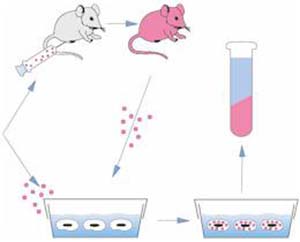
Cuando emerge una nueva enfermedad cuyo origen viral se sospecha, es fundamental identificar al virus asociado. Para ello se puede intentar hacer crecer el agente sospechoso inoculando animales o células en cultivo con fluidos o tejidos del individuo infectado (Fig. II). Una vez aislado el agente patógeno se puede proceder a su purificación y caracterización. El aislamiento de un virus puede llevar meses o años y el trabajo, por su peligrosidad si se trata de un patógeno, se efectúa en laboratorios especiales, que garanticen la seguridad. Actualmente es usual que un virus sea identificado antes de aislarlo (Fig. III).
Tanto el ARN como el ADN están constituidos por cuatro componentes, que en el ARN son A,U,C,G y en el ADN, A,T,C,G. (Fig. III). El orden –es decir, la secuencia– en que se ubican estos componentes determina las características de cada virus. El agregado, la desaparición o la substitución de un componente por otro en la secuencia del ARN o del ADN constituye una mutación del material genético, por la que el virus adquiere propiedades distintas: en eso consiste su evolución. Los virus tienen gran capacidad natural de mutar pero, al mismo tiempo, su evolución está restringida por la necesidad de vivir en ciertas células, en las que muchos de los mutantes no pueden hacerlo. Sin embargo, dichos mutantes tienen la capacidad potencial de adaptarse a vivir en células diferentes.
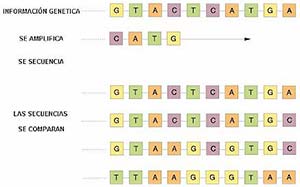
Actualmente, es relativamente rutinario secuenciar el ARN y el ADN, es decir, determinar el orden de sus cuatro componentes. Se lo puede hacer a partir de una ínfima cantidad de material genético, ya que existen técnicas que permiten amplificar a este antes de realizar la secuenciación (véase ‘La reacción en cadena de la polimerasa’, Ciencia Hoy, 23:52). Una vez obtenida la secuencia del ARN o el ADN de un virus, se la compara con las de virus previamente identificados, almacenadas en bases de datos. Puede suceder que la secuencia obtenida sea idéntica a la de un virus conocido, o que se trate de la de un mutante de un virus conocido; o que la secuencia permita la ubicación del virus dentro de un género o familia, pero que sea lo suficientemente diferente de la de virus conocidos como para postular que se trata de un virus nuevo. Este procedimiento ha posibilitado identificar virus causantes de enfermedades antes de efectuarse su aislamiento, lo que representa una gran ventaja con respecto a técnicas anteriores.
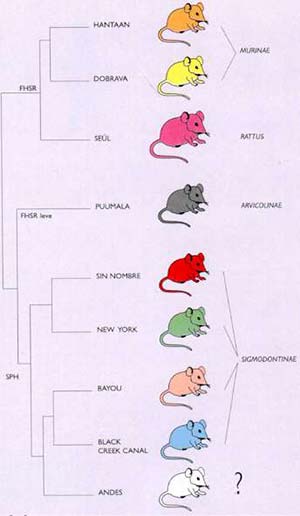
Los árboles filogenéticos permiten establecer relaciones entre diferentes organismos, incluidos los virus. Un árbol filogenético se puede construir por comparación de las secuencias de los genes virales. Tomemos como ejemplo las secuencias I a IV de ADN que se muestran en la figura III: se puede observar que la diferencia entre las secuencias I y II radica en un solo componente (C por A). Las secuencias I y III difieren en tres componentes. La IV está más distante de la II que de la III. El árbol filogenético de los hantavirus (Fig. 2) fue construido sobre la base de las diferencias entre las secuencias de los genes de los distintos virus, que fueron comparadas con ayuda de una computadora.











