Un grupo de investigadores argentinos determinó que una proteína secretada por los melanomas humanos sería la responsable del poder tumorigénico de estas células. Entrevista al responsable del grupo de trabajo, Osvaldo Podhajcer, y breve descripción de las técnicas que utilizan moléculas antisense.
ENTREVISTA AL DOCTOR OSVALDO PODHAJCER
El melanoma, la forma más grave de cáncer de piel, podría ser regulado por la síntesis de una proteína denominada SPARC, cuya supresión provoca la pérdida de malignidad de los células.

Un grupo de investigadores de la Fundación Campomar, en colaboración con el Hospital Eva Perón, de San Martín, Provincia de Buenos Aires, y el Kennedy Institute of Rheumatology, de Londres, publicó un trabajo en el número de febrero de la revista Nature Medicine en el que se comunica que la producción de una proteína conocida como SPARC está asociada con la actividad tumorigénica de las células de melanomas humanos. Osvaldo Podhajcer, responsable del grupo de investigación, nos relata cómo se llegó a estos resultados y cuáles son los obstáculos, ajenos al laboratorio, que se deben superar sí se desea lograr el desarrollo de un producto biotecnológico con fines terapéuticos.
Sugerimos al lector poco familiarizado con los temas de biología molecular que consulte los recuadros explicativos antes de concentrarse en la entrevista.
¿Qué es un melanoma?
El melanoma cutáneo resulta de la transformación maligna de las células pigmentadas de la piel, los melanocitos. Es uno de los tipos de cáncer más agresivo; si es detectado a tiempo hay aproximadamente un 95% de probabilidad de cura, mientras que en estadios más avanzados se estima un 95% de muerte luego de transcurridos unos cinco años. El problema es que hasta el momento no hay un tratamiento para el melanoma avanzado.
¿Cuándo comenzó o trabajar en este proyecto de investigación sobre melanomas?
Hacia el año 1991, en Francia, comencé a trabajar en expresión diferencial de genes, esto es, en tratar de establecer si algún gen está más expresado en tumores que en tejidos normales. Aislábamos genes cuyos ARN mensajeros estaban sobreproducidos en cáncer de mama humano. Investigamos especialmente sobre un gen asociado a la producción de una proteína llamada SPARC u osteonectina, de la cual ya se conocía su estructura pero no su función. Regresé al país a mediados de 1992 y por un tiempo estuve ocupado en otro tema; a fines de 1993 decidí retomar lo que había hecho en Francia, si bien ya no en cáncer de mama sino en melanomas. En ese momento se incorporó mi primera becaria, Fernanda Ledda, quien resultó ser luego la primera autora del trabajo publicado en Nature Medicine, que es parte de su tema de tesis doctoral; puede decirse que en ese momento comenzó el proyecto.
Lo primero que hicimos fue tratar de establecer si había una sobreproducción de SPARC o de su mensajero en los melanomas. Se trabajó con líneas celulares establecidas in vitro a partir de tumores de pacientes que presentaban metástasis de melanoma y también sobre cortes histológicos de esos tumores. Confirmamos que, efectivamente, había una sobreproducción de SPARC. En este punto se dio lo que yo llamo el 5% de visión u olfato: apareció una publicación en la que se demostraba que el gen de SPARC estaba presente tanto en gusanos, el Caenorhabditis elegans, como en seres humanos. Si esto es así, pensamos, si Natura ha preservado la presencia de este gen desde animales tan rudimentarios hasta el ser humano, es porque evidentemente debe tener una funcionalidad preponderante.
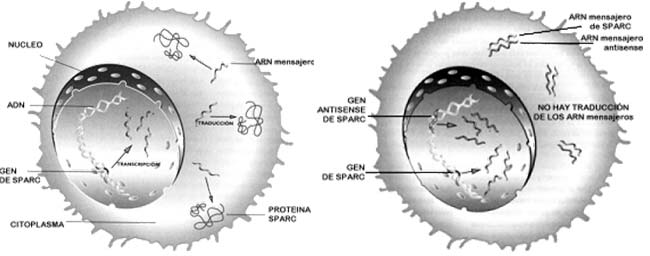
En este punto se incorporó una estudiante de biología, Soraya Adris, que también tuvo un papel muy importante en esta investigación. Diseñamos una molécula antisense, o sea la imagen especular del ARN mensajero de SPARC, y con ella manipulamos genéticamente las células de melanoma. Sabíamos que si se toman las células malignas de un paciente y se las inyecta en animales que no rechazan el implante de tumores humanos, como es el caso de los ratones nude o atímicos, la célula del melanoma crece en el ratón como lo hace en el humano: el implante realiza-do debajo de la piel produce un tumor que luego se disemina por todo el organIsmo. Hicimos exactamente lo mismo con las células que habíamos modificado con el antisense, y ocurrió que al cabo de una semana no hubo prácticamente células tumorales vivas. En estudios aún no publicados observamos que en las células tumorales que tienen disminuida la expresión de SPARC por la presencia de la molécula antisense, se produce una señal que induce un rechazo inmunológico.
¿Cuál diría usted que es el punto crucial de sus experimentos?
Yo señalaría dos momentos: el diseño de la molécula antisense y el tipo de respuesta final. Respecto del primer punto, nos preguntamos de qué manera se puede reducir la expresión de una proteína. El proceso puede ser bloqueado al principio -o sea impedir la síntesis de la proteína- o al final, empleando un anticuerpo para neutralizar la actividad de la proteína secretada por la célula. Esto último no funcionó, quizás debido a la estructura de la proteína, a la forma en que esta se inserta en la membraba celular e interacciona con ella, o a algún otro factor que no controlamos. Concretamente, el anticuerpo no sirvió pero, en cambio, el uso de la molécula antisense resultó fructífero.
El otro aspecto relevante del trabajo es la respuesta inmunológica o antitumoral asociada con la adquisición del antisense. Si se tienen díez células tumorales y se inyecta el antisense, para que las díez se mueran se necesita que todas ellas incorporen el gen. Este era el tipo de respuesta que esperábamos. Sin embargo, lo que aparentemente ocurre es que no es necesario que las díez células incorporen el antisense, sino que alcanza con que dos o tres lo hagan, ya que se produce una respuesta masiva que elimina todas las células. Esto nos da la pauta de que, tal vez, estemos frente a un proceso mucho más importante que una simple inhibición por bloqueo de expresión, lo cual seria, desde el punto de vista terapéutico, sumamente valioso. En este momento estamos estudiando este fenómeno con más profundidad.
¿Esperaban estos resultados?
En absoluto; lo único que sabíamos era que la proteína SPARC estaba sobreproducida en melanomas y que provenía de un gen relevante, puesto que la evolución lo había conservado. Fue sobre la base de estas observaciones previas que pensamos en la posibilidad de encontrar algo importante. De ahí en más, el azar.
¿Qué nos puede decir acerca de la posibilidad de la aplicación terapéutica de sus experimentos?
Estamos encarando tres estrategias diferentes: usar el gen antisense transferido mediante un vector, utilizar un oligonucleótido antisense (no todo el gen, sino un fragmento de ADN que corresponde a la parte inicial del gen) y emplear la célula tumoral con el antisense incorporado; en este último caso se trataría de una vacunación, en la cual la célula transformada debería ser irradiada antes de ser administrada. Pensamos que esta estrategia será la primera en llevarse a cabo.
En el comentario con que la revista Nature Medicine acompaña su trabajo se hace hincapié en la importancia de la disminución tanto de la capacidad invasiva coma adhesiva de las células tumorales. ¿Podría aclararnos este punta?
Como ya expliqué, la disminución de la expresión del gen de SPARC indujo la pérdida de la capacidad tumorigénica de las células en experiencias realizadas in vivo; por otra parte, se perdió la propiedad que tenía el tumor original de adherirse a un tejido normal para luego invadirlo. Si asociamos estas observaciones podemos proponer que esta proteína desempeña un papel preponderante en los procesos metastásicos.
El primer cambio en una célula que se transforma en maligna es su pérdida de adhesividad: comienza a migrar para llegar al sistema sanguíneo y entrar en la circulación. Para poder atravesar el tejido normal, debe romperlo, pero además necesita adherirse, ya que avanza un pequeño tramo y se vuelve a pegar para recomenzar su desplazamiento. La capacidad de la célula tumoral de adherir-se es importante al inicio y al final del proceso, cuando va a metastatizar, pues una vez que atraviesa el endotelio, entra en los vasos, viaja por el torrente sanguíneo, sale de él y se adhiere al tejido normal para proliferar y originar la metástasis. Si no se puede adherir esta última no se produce. En cambio, la capacidad invasiva de la célula es importante al comienzo, cuando tiene que romper el tejido normal que la rodea.
¿Qué se hizo una vez obtenidos los resultados?
A inicios de 1996 sugerí a las autoridades de Campomar el patentamiento en el exterior; la respuesta fue que no había dinero para hacerlo. La Fundación se comunicó con el CONICET, donde contestaron que tampoco lo había y que desconocían la forma de tramitar una patente fuera del país. Yo consideraba que nuestros resultados eran importantes, por los comentarios que recibía de colegas del exterior, por lo que me dirigí a tres empresas farmacéuticas argentinas, las cuales tampoco aceptaron hacerlo. Decidí entonces enviar el articulo para su publicación, aun sabiendo que cuando un hallazgo se hace de dominio público se pierden los derechos de patentamiento. Es entonces cuando, habiendo sido invitado a un congreso en Oxford, me pongo en contacto con una empresa para ver si era posible hacer algo antes de que se publicaran nuestros resultados. Luego de evaluar el proyecto me contestaron que iniciarían el trámite de patentamiento; la solicitud entró en la oficina de patentes el 27 de diciembre de 1996, cuando el trabajo ya estaba en prensa.
¿Qué se patentó?
En Estados Unidos se está intentando patentar la secuencia de genes, independientemente de que se conozca o no su uso, lo cual plantea el problema de si un producto natural, como lo es un gen, puede ser patentable. La Comunidad Europea no acepta el parentamiento de genes, pero sí el uso terapéutico de estrategias antisense, en nuestro caso para bloquear el gen SPARC en la terapia del cáncer en general, ya que hay sobreproducción de SPARC en diferentes clases de tumores, por lo cual, hipotéticamente, esta terapia podría ser utilizada también en ellos.
¿Cuál es la situación actual?
La posibilidad de continuidad de nuestras investigaciones se da en dos planos. En primer lugar, seguimos adelante con el trámite de patentamiento en Inglaterra y EE.UU. a nombre de la Fundación Campomar y de CONICET. Cabe aclarar que en la Argentina, según la legislación vigente, no existe la posibilidad de preservar este hallazgo científico; el objetivo es, por lo tanto, reforzarlo, para que la patente sea finalmente otorgada. Como este trámite puede demorar dos años, es necesario decidir si se inicia el patentamiento en otros países sobre la base de lo que ya se hizo. Esto va en paralelo con la posibilidad de diseñar un producto biotecnológico para uso en seres humanos, para lo cual esta-mos tratando de reunir alrededor de 500.000 dólares.
En este momento hay varias fundaciones que están evaluando el proyecto, pero la única que, hasta el momento, nos otorgó un subsidio importante fue la Fundación YPF. La Fundación Baron nos ha hecho llegar una suma modesta, pero está considerando la posibilidad de apoyar el proyecto. Poseemos subsidios del exterior, pero están relacionados con la investigación básica, no con la aplicación directa de los resultados. Si se me pregunta qué pasa con el estado, que debería apoyar la investigación hasta alcanzar la etapa en la que aparezca una empresa que tenga un interés concreto, todo lo que puedo decir es que hasta el momento se está realizando una evaluación, aunque no conozco el estado de avance de esta. Con respecto al ámbito privado, una única empresa nacional se acercó y manifestó mucho interés. Una sola. También lo hicieron una compañía y un fondo de inversión, ambos norteamericanos.
La relación entre las empresas y las instituciones académicas, hecho muy frecuente en el exterior, es muy lenta en nuestro país, creo que por falta de experiencia mutua. En general, las empresas argentinas tienden a trabajar sobre productos conocidos y se amparan en la ley de patentes, que permite la copia sin pago de royalties. De todos modos, esto en algún momento va a tener que cambiar, porque una vez que se apruebe definitivamente la decisión del GATT (General Agreement on Tariff and Trade), se van a tener que pagar rayalties sobre todo. Creo que es un momento ideal para que las empresas argentinas Comiencen a apoyar proyectos genuinos de innovación tecnológica, sobre cuya producción y comercialización se pueda tener el derecho. Algunos investigadores me han llamando para preguntarme sobre el trámite del patentamiento, y también me voy a reunir con la Comisión de Ciencia y Tecnología de la Cámara de Diputados, porque ellos quieren saber por qué hubo que iniciar la patente en el exterior, por qué no se pudo hacerlo en la Argentina, etc. Me parece que en nuestro país muy poca gente sabe algo sobre la ley de patentes.
En nuestro caso, la patente no es británica, sino una patente argentina hecha en el exterior. No hubo ningún diario que preguntara a un experto en patentes cuál era la verdad de esto. Si me piden opinión, yo creo que los fondos deberían poder obtenerse en el país. Es aquí donde se tienen que encontrar los mecanismos necesarios para lograr un producto biotecnológico potable y luego ofrecerlo.
¿Piensa que está en desventaja para competir con grupos del exterior?
El hecho de que tardáramos en publicar nos dio cierta ventaja. Sin embargo, a partir de ahora, la competencia va a ser terrible, porque hay grupos importantes en el exterior. En Seattle está Helene Sage, la persona que realizó el comentario de nuestro articulo en Nature Medicine, quien es una experta mundial en SPARC; por el número de autores que aparecen en sus artículos, hay por lo menos diez investigadores involucrados en este tema. Hay también un grupo alemán muy fuerte en el Max Plank Institute, que hace cristalografía y que ya tiene mutantes para la proteína. Sin embargo, creo que seguimos teniendo una ventaja, que consiste en el enfoque inmunológico que hacemos del problema, y en que ya tenemos células y vectores preparados.
¿Cuáles san los pasos para el futuro?
Debemos finalizar el diseño del producto, su producción a escala, el ensayo clínica en seres humanos y la eventual comercialización de acá a varios años. Nadie puede afirmar que este proyecto vaya a funcionar pero, en caso positivo, la inversión a realizar es ínfima frente al enorme beneficio social y, eventualmente, económico.