Usando optogenética para iluminar el estudio del cerebro
Desde hace muchos años en la comunidad neurocientífica se pensaba que la revolución en el estudio del cerebro iba a ir de la mano del control de la actividad de ciertas neuronas independientemente de otras. El propio Francis Crick, ganador del premio Nobel en 1962 por su contribución al descubrimiento de la estructura química del ácido desoxirribonucleico (ADN), lo mencionó en su análisis sobre los desafíos para el avance de las neurociencias: ‘Un requerimiento sería prender o apagar uno o más tipos de neuronas… de manera rápida. La señal ideal sería la luz… Suena descabellado, pero es concebible que biólogos moleculares puedan diseñar que un tipo de célula sea sensible a luz’ (Crick, ver ‘Lecturas sugeridas’). Bastante acertado estaba, pues la biología celular y las neurociencias convergieron gracias a la biología molecular para dar un salto abismal en el entendimiento de los procesos que ocurren en el cerebro. Nos referimos al desarrollo de la optogenética, una poderosa herramienta para estudiar circuitos neuronales que, como lo indica su nombre, depende de la luz (opto) y es introducida en las células a estudiar a través de técnicas de ingeniería genética.
Existen células que naturalmente expresan proteínas sensibles a la luz. Los genes que codifican este tipo de proteínas, llamadas opsinas, están divididos en dos grandes familias dependiendo su origen. La familia tipo I incluye a las opsinas que provienen de microorganismos como algas unicelulares, hongos y bacterias, mientras que la familia tipo II incluye a las presentes en células de organismos más complejos, como células del sistema visual de vertebrados. Para su correcto funcionamiento ambos tipos de opsinas requieren un cofactor derivado de la vitamina A llamado retinal, que sirve de antena en la detección de luz. Cuando el retinal se une a la opsina otorgándole funcionalidad, lo llamamos rodopsina. Si bien los dos tipos de familias de opsinas son proteínas que se ubican en la membrana celular, los mecanismos que desencadenan una vez que se activan son diferentes. Las de tipo I constituyen una familia de proteínas que permiten, ellas mismas, el flujo de iones a través de la membrana celular, es decir, forman lo que llamamos un canal. Por otro lado, las de tipo II son un tipo especial de receptores (llamados receptores acoplados a proteína G), que una vez activados desencadenan una serie de cascadas de señalización celular.
¿DE QUÉ SE TRATA?
En este trabajo se describe el desarrollo de la optogenética, una poderosa herramienta para estudiar circuitos neuronales que, como lo indica su nombre, depende de la luz (opto) y es introducida en las células a estudiar a través de técnicas de ingeniería genética.
Y aquí lo importante: el flujo de iones. El lenguaje que utilizan las neuronas para codificar información es el de las señales eléctricas, que eventualmente se traducen a señales químicas. Estas señales pueden ocurrir gracias a dos motivos principales. Por un lado, las células mantienen activamente una diferencia de potencial a ambos lados de la membrana (siendo el interior de la célula más negativo que el exterior). Este potencial de membrana está determinado por varios factores, entre ellos la existencia de iones que se distribuyen de manera diferencial a ambos lados de la membrana, sumado a la presencia dentro de la célula de moléculas que poseen carga eléctrica y a la expresión de proteínas en la membrana plasmática que permiten el paso de ciertos iones a través de ella. Este paso de iones puede ser a favor de su gradiente electroquímico, es decir considerando las diferencias de concentración, pero también la fuerza eléctrica (en cuyo caso estas proteínas se denominan canales, una suerte de poros moleculares anclados en la membrana), o en contra de ese gradiente (en cuyo caso se denominan bombas o transportadores). Por otro lado, las células excitables como las neuronas expresan en su membrana, además, ciertos tipos de canales particulares que solo se abren en determinadas situaciones. La apertura de estos poros permitiendo el paso de iones generará cambios en el potencial de membrana, y estos cambios constituyen una señal eléctrica. El tipo de canal activado, y por ende la identidad de los iones a los que sea permeable, determina el sentido del cambio en el potencial de la membrana y, por lo tanto, si la neurona se inhibe o se excita. Cuando la apertura de un canal permite la entrada neta de cargas negativas –o salida neta de cargas positivas–, la membrana se hiperpolariza (el interior de la célula se hace más negativo respecto del exterior), tratándose de una inhibición. Cuando, en cambio, lo que ocurre es la entrada neta de cargas positivas –o salida neta de cargas negativas– hablamos de una despolarización (el interior de la célula se hace menos negativo que antes respecto del exterior, e incluso puede hacerse positivo), que conlleva a la excitación neuronal. Si la despolarización es tal que a su vez permite la apertura de más canales, puede ser que la neurona dispare lo que se llama potencial de acción, un cambio drástico y rápido del potencial de membrana que eventualmente termina en la liberación del neurotransmisor, esa señal química que impactará en la neurona con la que hace sinapsis. Queda clara entonces la enorme potencialidad de la activación de rodopsinas sobre la modulación de la actividad de las neuronas que las expresan: la excitabilidad de las neuronas depende del flujo de iones… ¡Y hay rodopsinas que, ellas mismas, al captar luz generan flujos de iones!
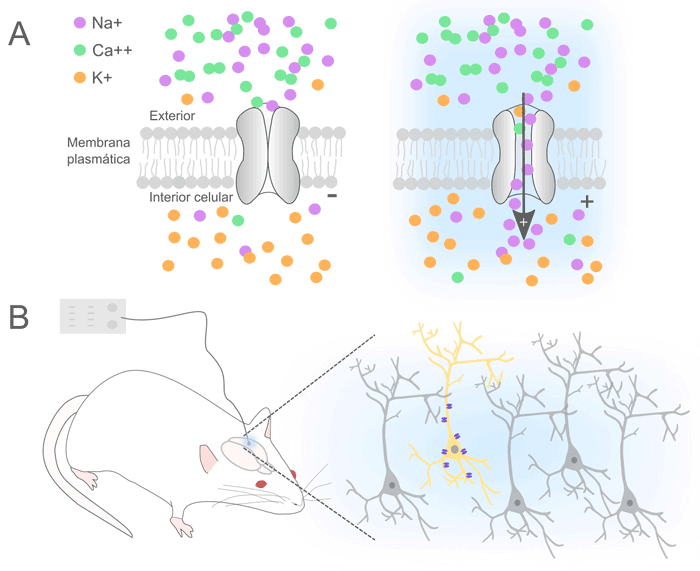
Ahora bien, el cómo surgieron los descubrimientos científicos que a la larga permitieron el uso de la optogenética como herramienta para modular la actividad neuronal nada tuvo que ver con ese objetivo. De hecho, la historia del desarrollo de la optogenética muestra, una vez más, la importancia de la ciencia básica: el conocer por el simple hecho de conocer. Y no solo eso: también el hecho de cómo los prejuicios pueden enlentecer el avance científico. Ya en la década de 1970 habían sido publicados los primeros trabajos identificando a las bacteriorodopsinas o bacteriorhodopsins, bombas de protones (H+) que ante condiciones de bajo oxígeno se expresan en grandes cantidades en la membrana plasmática de ciertos microorganismos favoreciendo la producción de energía. En los años siguientes no solo se profundizó sobre los mecanismos funcionales subyacentes sino que se descubrieron otras rodopsinas naturales como las halorhodopsins y channelrhodopsins. ¿Por qué tardó tanto el desarrollo de la optogenética entonces? Por un lado, existía el prejuicio de que componentes simples o ‘únicos’ (codificados por un solo gen) como las opsinas, provenientes de organismos evolutivamente tan alejados, resultaran en una baja expresión, fueran tóxicas en células como neuronas, o no sirvieran para generar señales eléctricas relevantes. Probablemente influenciados por estas dudas razonables, varios grupos de investigación enfocaban sus esfuerzos en el desarrollo de herramientas ópticas pero que involucraban múltiples componentes (cascadas de activación de varios genes junto a compuestos químicos sensibles a luz). También existía la duda de si el retinal, ese componente indispensable para el funcionamiento de las opsinas, se expresaría naturalmente y en cantidades suficientes en neuronas (luego se descubrió que sí). Por otro lado, había más cuestiones por resolver: lograr que neuronas de determinados organismos útiles para el estudio de las neurociencias en el laboratorio (como moscas, gusanos, ratas, ratones, monos) pudieran efectivamente expresar los genes codificantes para esas proteínas, que eran originalmente funcionales en otros tipos celulares evolutivamente alejados. Y como si todo esto no fuera poco, también existía la complicación experimental de lograr que la luz llegase a las neuronas en estudio en pulsos capaces de emular las señales eléctricas neuronales con una resolución temporal que tuviera sentido fisiológico.
Fue en 2005 cuando el grupo de Karl Deisseroth, de la Universidad de Stanford, California, publicó un trabajo pionero en el que se mostraba exitosamente cómo la estimulación lumínica sobre neuronas de mamífero que expresaban la opsina channelrhodopsin-2 proveniente del alga unicelular Chlamydomonas reinhardtii generaba que esas neuronas aumentaran su actividad eléctrica y dispararan potenciales de acción (ver Boyden en ‘Lecturas sugeridas’). Lo que hacía la estimulación lumínica en esas células era que channelrhodopsin-2 pasara a su conformación activa y permitiera el paso de cationes (iones con carga positiva) tales como sodio, calcio y potasio a favor de su gradiente de electroquímico. En condiciones normales de una neurona, la activación de channelrhodopsin-2 genera una entrada de carga neta positiva (figura A) que, como mencionamos anteriormente, equivale a una despolarización, e implica una excitación. Pero una cosa es iluminar neuronas que están creciendo en lo que se llama un cultivo celular (es decir, neuronas obtenidas del cerebro de un animal de experimentación, y puestas a crecer en una placa de plástico con un medio de cultivo que aporte los nutrientes necesarios, a una temperatura y pH controlados), como hicieron en el trabajo publicado por el grupo de Deisseroth, y otra es pensar en iluminar neuronas en un cerebro de un animal vivo, e incluso realizando alguna tarea. Lo cierto es que en el campo de las neurociencias desde hace tiempo que se usan técnicas invasivas en animales de experimentación para el estudio del cerebro, aplicadas bajo estrictos protocolos de laboratorio aprobados por comités de ética pertinentes. Un ejemplo es la colocación de cánulas permanentes mediante cirugías estereotáxicas (es decir, en determinadas coordenadas específicas del cerebro, basándose en mapas espaciales construidos por neurocientíficos hace ya muchos años) con las que es posible administrar fármacos de manera controlada y localizada. Otro ejemplo es la colocación de implantes con electrodos que detectan actividad neuronal o la inducen mediante aplicación de corriente, también utilizando cirugías estereotáxicas. La administración de luz hacia dentro del cerebro no constituyó realmente un problema tecnológico en sí mismo. De hecho, aunque suene irónico, se utilizó –y se sigue utilizando– tecnología relevante en el campo de las comunicaciones: las fibras ópticas, que transmiten la luz de manera muy eficiente y pueden ser lo suficientemente pequeñas en diámetro –ideal para dañar el tejido lo menos posible–, pero a la vez resistentes como para atravesar tejido y llegar a la zona de interés (figura B).
Todo muy lindo, pero… ¿cuán fácil es expresar estas proteínas provenientes de microorganismos en las neuronas de interés? De mínima, es necesario modificar la secuencia nucleotídica de los genes que las codifican de manera que puedan expresarse en las células de interés que, como decíamos antes, suelen pertenecer a organismos diferentes de los de origen, como los distintos animales de laboratorio (e incluso eventualmente humanos). Para lograr la expresión de estas opsinas se utilizan principalmente dos estrategias (o la combinación de ambas), y su elección depende de múltiples factores. Una de esas estrategias es diseñando un animal transgénico que contenga en su genoma el gen en cuestión. Este gen, a su vez, debe incluir regiones regulatorias –i.e. promotores– que permitan su expresión. Justamente, la utilización y elección de promotores otorga lo que se llama especificidad: si bien ese gen se encuentra en el genoma de todas las células, solo se transcribirá (y finalmente producirá la proteína de interés) en aquellas que tengan la maquinaria molecular necesaria para reconocer dichos promotores. La segunda estrategia es usar vectores virales, que son virus modificados capaces de infectar específicamente ciertas células e introducir en ellas el genoma que llevan, que, en este caso, incluye el gen de la opsina. Aquí no solo hay que considerar que estos virus modificados tengan la capacidad de infectar las células de interés (y no otras), sino también que el gen introducido incluya un promotor que permita su transcripción en las células infectadas. En otras palabras, cuando se usan vectores virales importa tanto que el virus tenga la capacidad de infectar la célula de interés como que el gen introducido tenga la región regulatoria que sea reconocible por la maquinaria molecular de esa célula infectada. Así, los controles de expresión selectiva son extremadamente relevantes, pues la optogenética no solo permite el control de cuándo –luz prendida– sino de dónde, y ese dónde implica tanto la posibilidad de modular alguna zona cerebral de interés, pero también determinados tipos de neuronas –y no otras– dentro de una misma región. Esto último representa una de las principales ventajas de la optogenética frente a otras técnicas más tradicionales pero menos selectivas que inducen actividad neuronal, como la estimulación eléctrica directa.
La modulación de la actividad neuronal no solo implica aumentar la actividad de ciertas neuronas en un momento dado. También es deseable experimentalmente poder inhibir esa actividad, lo que constituye de hecho una herramienta muy importante a la hora de estudiar si tales o cuales neuronas son necesarias para que un animal lleve a cabo determinada tarea: si se las inhibe y la tarea se ve afectada, entonces se puede concluir que dichas neuronas eran necesarias. Afortunadamente para la ciencia, además de rodopsinas que excitan a las neuronas, también existen otras rodopsinas que, una vez activas, inhiben a las neuronas que las expresan. Estas rodopsinas inhibitorias mueven iones de manera tal que generan que el interior de la neurona se vuelva más negativo, haciendo que sea más difícil disparar potenciales de acción. Las rodopsinas inhibitorias que más frecuentemente se usan en optogenética son aquellas que bombean iones: cloruro (Cl-) hacia el interior de la célula (halorhodopsin) o protones (H+) hacia el exterior (archaeorhodopsin). Es interesante resaltar que los distintos tipos de rodopsinas, tanto excitatorias como inhibitorias, son sensibles a luz de distintas longitudes de onda. Por ejemplo, channelrhodopsin-2 es sensible a luz azul (~480nm), mientras que halorhodopsin es sensible a luz amarilla (~570nm). Esto permite expresar ambas proteínas en una misma neurona, y activarla o inhibirla según la longitud de onda de la luz utilizada.
Las opsinas, entonces, parecieran ser herramientas naturales al servicio de la ciencia: se activan con determinadas longitudes de onda, y la activación de las neuronas utilizando esta metodología mimetiza bastante bien la actividad natural de estas. Todo esto sin mucha más modificación que para permitir su expresión en las células de interés. No obstante, lo que la naturaleza no provee, en el laboratorio se busca. Desde el momento en que comenzó el desarrollo y uso de la optogenética como herramienta útil para modular la actividad neuronal se trabaja incansablemente en perfeccionar distintos aspectos metodológicos para extender los límites de su utilidad. Por un lado, mejoras sobre las mismas opsinas: algunos ejemplos incluyen modificaciones en los genes que las codifican con objetivos como modificar la amplitud y velocidad de las respuestas, lograr un control de localización diferencial dentro de la neurona de interés, o modificar la longitud de onda que las activa. En cuanto a esto último, sucede que la luz azul o amarilla (que activa channelrhodopsin o halorhodopsin, respectivamente) no penetra grandes distancias en el tejido, pues es absorbida por distintas moléculas que encuentra a su paso. En cambio, la luz roja presenta mayor penetrancia, permitiendo que la fuente de luz esté a mayor distancia de la célula que expresa la opsina. Esta luz roja de gran penetrancia es particularmente útil cuando se estudian animales pequeños, como moscas: basta con iluminar desde el exterior, que con seguridad se estará irradiando el cuerpo entero y activando las rodopsinas donde quiera que se hayan expresado. Por otro lado, también día a día se intenta mejorar no solo las metodologías asociadas con una expresión exitosa de la opsina de interés en tipos específicos de células del sistema nervioso, sino también las vías de administración de luz a esas células o regiones específicas incluso cuando el sujeto experimental realiza conductas que implican movimiento.
Así, la optogenética se posiciona como una poderosa y versátil herramienta que ha logrado gran precisión temporal y celular para la activación o inhibición de la actividad neuronal, en una gran variedad de modelos animales, e incluso en animales comportándose libremente y resolviendo tareas. La incorporación de la optogenética como herramienta en un laboratorio de neurociencias es absolutamente factible. Es una técnica relativamente accesible: básicamente necesita de (i) el gen que codifica la opsina de interés; (ii) un método para lograr que ese gen esté presente en las células de interés (y que además se exprese), sea utilizando animales transgénicos o administrando virus modificados para tal fin –o combinando ambas opciones–, y (iii) una fuente de luz, sea un láser o incluso un diodo emisor de luz (también conocido como LED, por su sigla en inglés) sumado a una manera de entregar al tejido en estudio esa luz (por ejemplo, usando fibras ópticas). Lo más difícil: la pregunta científica que se quiera contestar. Las aplicaciones de la optogenética van desde la ciencia básica –por ejemplo, estudiando mecanismos neuronales y de circuitos que subyacen a los distintos comportamientos animales– hasta la ciencia aplicada. Sin ir más lejos, el 24 de mayo de este año se publicó en la prestigiosa revista Nature Medicine un trabajo promisorio (ver Sahel et al., en ‘Lecturas sugeridas’) en el que se muestra cómo la utilización de la optogenética permitió restaurar parcialmente la visión en un paciente con un tipo particular de ceguera, la retinitis pigmentosa, una enfermedad neurodegenerativa progresiva de origen genético. En este trabajo utilizaron el gen de la opsina ChrimsonR (un tipo de channelrhodopsin), administrado utilizando vectores virales que infectan células ganglionares de la retina. La luz que activa ChrimsonR es color ámbar (cerca del rojo en el espectro de luz), y la forma de “estimulación” para el paciente fue la utilización de anteojos especiales que transforman los eventos lumínicos de las imágenes reales en monocromáticos, pudiendo activar así la opsina. La utilización exponencial de la optogenética como herramienta para entender el funcionamiento del sistema nervioso, la cantidad de laboratorios que la utilizan desde que está disponible y la potencialidad en cuanto a terapias regenerativas o de recuperación de función pone a las personas que la desarrollaron como grandes candidatos y candidatas para premio Nobel. El misterio está en quién o quiénes serán las personas laureadas debido a la enorme contribución interdisciplinaria que llevó a su desarrollo. Para eso sí habrá que esperar… quién sabe cuánto.
Lecturas sugeridas
BOYDEN ES, ZHANG F, BAMBERG E, NAGEL G & DEISSEROTH K, 2005, ‘Millisecond-timescale, genetically targeted optical control of neural activity’, Nature Neuroscience, 8: 1263-1268.DOI 10.1038/nn1525
CRICK F, 1999, ‘The impact of molecular biology on neuroscience’, Philosophical Transactions of the Royal Society B: Biological Sciences, 354, 2021. DOI 10.1098/rstb.1999.0541
SAHEL JA, BOULANGER-SCEMAMA E, PAGOT C et al., 2021, ‘Partial recovery of visual function in a blind patient after optogenetic therapy’, Nature Medicine. DOI 10.1038/s41591-021-01351-4
YIZHAR O, FENNO LE, DAVIDSON TJ, MOGRI M, & DEISSEROTH K, 2011, ‘Optogenetics in neural systems’, Neuron, 71: 9-34. DOI 0.1016/j.neuron.2011.06.004
Doctora en ciencias biológicas, UBA.
Jefa de trabajos prácticos, DFBMC, FCEN, UBA.
Investigadora asistente en el IFIBYNE, UBA-Conicet.










