El tamoxifeno es un fármaco usado con éxito para tratar el 70% de los cánceres de mama, pero dos de cada tres pacientes desarrolla con el tiempo resistencia a la droga. ¿Qué factores explican esa resistencia y el 30% de casos en que no surte efecto?
Mecanismos de control celular y cáncer
Los primeros documentos conocidos que describen un cáncer provienen del antiguo Egipto y datan de hace aproximadamente 3600 años. Alrededor del año 400 antes de nuestra era, el llamado padre de la medicina, Hipócrates, llamó a la enfermedad carcinoma (del griego karkinos o cangrejo). De ahí proviene el nombre que usamos hoy, aunque la razón por la que Hipócrates asoció los tumores que observaba con los cangrejos es materia de discusión.
¿Qué es el cáncer? Si buscáramos la palabra en el diccionario moderno de la Real Academia Española, la encontraríamos definida como enfermedad neoplásica con transformación de las células, que proliferan de manera anormal e incontrolada, y también tumor maligno. En lenguaje médico, neoplasia indica tejidos anormales, por ejemplo, tumores. Básicamente, entonces, la causa primera y fundamental del cáncer es el descontrol de la proliferación celular.
¿Qué es la proliferación celular? Durante el desarrollo embrionario, la formación de todos los órganos de nuestro cuerpo es consecuencia de la duplicación celular: una célula que da origen a dos y así sucesivamente. Este proceso se conoce como división o proliferación celular. La proliferación celular también hace posible el crecimiento o la recuperación de células de algún tejido que se hubiesen perdido como consecuencia de un daño o herida.
Nuestro organismo posee varios complejos sistemas para regular la proliferación celular. Entre ellos se cuentan los llamados factores de crecimiento, que llevan a cabo un control fundamental. Son moléculas con la capacidad de indicar a determinada célula que debe proliferar. Pueden ser producidas por el mismo tejido en proliferación, por tejidos adyacentes o por glándulas lejanas que las secretan a la sangre. En este último caso, se las conoce también como hormonas. Para cumplir con su misión, activan sitios específicos de la célula que toman como blanco, denominados receptores, a los que se adhieren o unen. Un ejemplo de hormona es la insulina (véase Federico Coluccio Leskow, ‘Insulinas, metabolismo y crecimiento’, Ciencia Hoy, 23, 136: 15-18), que estimula la proliferación de músculo y tejido adiposo; otro es el factor de crecimiento epidérmico (o EGF, por epidermal growth factor), que participa en el desarrollo de diversos tejidos, desde el pelo hasta algunos tipos de neuronas. Y también es factor de crecimiento el estrógeno, responsable del desarrollo de la glándula mamaria, el útero y los ovarios. Los factores de crecimiento son, pues, una primera forma de control de la proliferación celular.
Sin embargo, si un tejido en activa proliferación contuviera células con alguna alteración genética, no sería conveniente que ellas proliferaran porque transferirían la mutación a las células hijas. En ese caso, dichas células, en lugar de dividirse, deberían morir, para no propagar la anomalía. Esa situación recibió el nombre de muerte celular programada o apoptosis, para distinguirla de otros tipos de muerte celular. Es un proceso que no provoca inflamación ni dolor y ocurre todo el tiempo sin que nos demos cuenta. La apoptosis, entonces, es un segundo mecanismo fundamental de control del número de células en un tejido. Se estima que perdemos una cantidad de células equivalente al 20% de nuestro peso corporal a lo largo de la vida, la mayoría de ellas por apoptosis.
Una tercera forma de control de la proliferación de nuestras células está relacionada con la historia de cada una de ellas. Cuando una célula supera una cierta cantidad de divisiones, entra en un estado no proliferativo llamado senescencia. Así se evita la acumulación de alteraciones en los genes que, por características propias de los mecanismos de duplicación del ADN, aparecen al cabo de numerosas divisiones celulares.
Hoy se cree que el primer paso del desarrollo de un tumor es que una célula adquiera la capacidad de proliferar de manera desregulada e ilimitada. Es decir, que se vuelva insensible a los mecanismos de control enumerados, lo que podría ocurrir si acumulara gran cantidad de mutaciones. En ese punto, se dice que es una célula transformada, la cual, además, debe pasar inadvertida por el sistema inmune del organismo, que tiene la capacidad de eliminar a cualquier célula que se comporte de modo extraño.
Si una célula lograra reunir todas estas condiciones, podría proliferar y generar un tumor. Junto con esto, los tumores suelen reclutar células normales en su apoyo, por ejemplo, para generar vasos sanguíneos que los nutran o para brindarles sostén mediante la constitución de una red de proteínas que los interconecte con células adyacentes. Esto se conoce como matriz extracelular de un tumor. Todos los tipos celulares que rodean a las células fundadoras de un tumor, junto con las proteínas de su matriz extracelular, conforman el microambiente tumoral.
Lo descripto hasta aquí es un tumor benigno, es decir, un crecimiento anormal de células restringido espacialmente. Si algunas de las células tumorales adquirieran, además, la capacidad de salir del nicho original, entrar en la circulación y colonizar un nuevo tejido (lo que se conoce como metástasis), el tumor se convierte en maligno y justifica hablar de cáncer.
En los últimos diez años ha crecido enormemente la investigación del microambiente tumoral y su participación en el cáncer. Se sabe hoy que la interacción entre las células que componen el tumor y su microambiente es tal que si se separa a las fundadoras y conductoras del desarrollo tumoral de las que forman su microambiente, se vuelven dramáticamente más sensibles a prácticamente cualquiera de las terapias conocidas.
Esto llevó a adoptar una visión mucho más integrativa de la enfermedad y a incluir en la ecuación no solo a las células cancerosas sino, también, a la arquitectura del microambiente tumoral y a la interacción entre todos los factores que lo componen.
La glándula mamaria y sus peculiaridades
La glándula mamaria es un órgano ramificado, fuertemente dependiente de hormonas (sobre todo estrógeno, progesterona y prolactina) y compuesto por dos capas epiteliales. La capa interna está formada por las células luminales y la externa por las células mioepiteliales, todas rodeadas por una membrana basal sumergida en una almohadilla de grasa. Estas células se organizan para formar la estructura de forma arbórea que caracteriza a esta glándula, compuesta por alvéolos (las unidades productoras de leche) interconectados por ductos (que conducen la leche hasta el pezón). Los grupos de alvéolos y ductos se denominan lóbulos y conforman la unidad funcional básica de la mama, llamada unidad terminal ducto-lobular. La gran mayoría de los tumores de mama se originan en las células epiteliales luminales que recubren los ductos y se denominan adenocarcinomas ductales (adeno indica glándula).
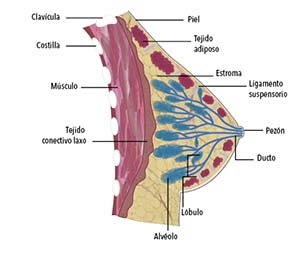
El desarrollo de la glándula mamaria abarca varias etapas. Comienza en el embrión y continúa en la pubertad. Las células epiteliales proliferan desde el pezón, invaden la almohadilla de grasa y forman las mencionadas estructuras ramificadas de ductos, que son rudimentarias en el embrión y se hacen complejas en la pubertad. En esta etapa de la vida, los ductos alcanzan el extremo de la almohadilla de grasa (donde forman los brotes terminales) y las células epiteliales dejan de proliferar, con lo que quedan grandes espacios sin ocupar hasta que ocurre un embarazo y la glándula alcanza su máximo desarrollo lóbulo-alveolar. Entonces aparecen ramas laterales que interconectan ductos y se forman los alvéolos que producirán leche durante la lactancia. Estas etapas de proliferación de las células epiteliales están gobernadas por estrógenos y progesterona. Al finalizar la lactancia, la glándula mamaria sufre un proceso de involución caracterizado por una muerte celular masiva y vuelve a un estado de desarrollo similar al que tenía antes del embarazo.
Cáncer de mama y tamoxifeno
El cáncer de mama es actualmente una de las principales causas de muerte en mujeres, tanto en el mundo como en la Argentina. Se estima que una de cada ocho mujeres entre los veinte y los setenta años lo padece. Probablemente la gran cantidad de trabajos de investigación realizados sobre esta enfermedad sea la causa de que, en los últimos cincuenta años, se hayan registrado importantes avances en materia de su prevención y terapia.
El primer gran adelanto se dio en la década de 1960 con el descubrimiento en la Universidad de Chicago, por el norteamericano Elwood Jensen (1920-2012), del tamoxifeno, un fármaco capaz de regular la actividad de los receptores del estrógeno. Este llega a las mamas desde los ovarios, se vincula con dichos receptores y pone así en marcha la proliferación de las células mamarias.
El tamoxifeno bloquea la acción del estrógeno (y por esa razón se lo conoce como el antagonista de este) e impide dicha proliferación. Ese efecto lo ha convertido en un excelente recurso terapéutico contra la proliferación de células tumorales mamarias.
Los resultados de los ensayos clínicos del tamoxifeno fueron positivos y, finalmente, la droga fue aprobada en 1977 para su uso en pacientes con cáncer de mama avanzado. Pero, por diversas razones, solo en junio de 1990 recibió aprobación como tratamiento para prevenir la recurrencia de la enfermedad en mujeres sin metástasis detectable en nódulos linfáticos.
Hoy el 70% de las mujeres operadas de cáncer de mama son tratadas con la droga durante cinco años luego de la cirugía. ¿Qué ocurre con el 30% restante? Sucede que en esas pacientes menos del 1% de células cancerosas son sensibles al estrógeno y por eso no se les prescribe el tratamiento con tamoxifeno. Esto se debe a que las células de los tumores no están igualmente dotadas de receptores de estrógeno. Quizá resulte raro, entonces, que se recete tamoxifeno a pacientes con, por ejemplo, solo 5% de células cancerosas sensibles al estrógeno. Ello se debe a que la experiencia clínica y los estudios de investigación básica hicieron ver que, por razones aún hoy no completamente dilucidadas, alcanza con tener el 1% de células cancerosas sensibles al estrógeno para que el tamoxifeno produzca resultados favorables.

Por otro lado, dos de cada tres mujeres tratadas con tamoxifeno desarrollan resistencia a la droga y el cáncer regresa. Se sabe hoy que en cerca de la mitad de ellas esa resistencia aparece al comienzo del tratamiento, mientras que en la otra mitad ocurre dentro de los diez años siguientes a terminado. Si bien los factores relacionados con la resistencia temprana han sido bien identificados, los responsables de la resistencia tardía no lo están y continúan siendo objeto de investigación.
Hacia principios de la década del 1990, luego de casi treinta años de buscar la forma de identificar inequívocamente tumores de mama resistentes al tamoxifeno, se descubrió que en muchos de ellos estaba presente una cantidad anormalmente alta de una proteína llamada HER2 (por human epidermal growth factor receptor 2), asociada con receptores de los factores de crecimiento.
Nuevas terapias
El HER2 es parte de una familia de receptores que participan en la proliferación y diferenciación de diversos tejidos, pero hasta donde se sabe no interactúa con ningún factor de crecimiento. Sin embargo, si su presencia es lo suficientemente abundante (como ocurre en ciertos tumores de mama muy agresivos), es capaz de autoactivarse, es decir, de enviar señales proliferativas aun en ausencia de factores de crecimiento. Por eso, altas cantidades de HER2 se toman como indicación de pobre respuesta al tratamiento con tamoxifeno y de presencia de un cáncer de mama con mala prognosis.
El descubrimiento de lo anterior convirtió al HER2 en un importante blanco de acciones que pudiesen beneficiar a pacientes con esa clase de tumores. De los numerosos caminos ensayados, el que ha resultado más eficaz ha sido la inmunoterapia, que se basa en la acción de anticuerpos bloqueantes, cuyo efecto es unirse al receptor e impedir su activación. Sin embargo, a lo sumo el 20% de los tumores resistentes al tamoxifeno responde a la inmunoterapia, lo que llevó a la búsqueda de otros posibles responsables de la resistencia al tamoxifeno. En esa investigación, durante la última década ha pasado al primer plano el estudio del microambiente tumoral.
Saber escuchar
Así como la comunicación es esencial para la vida de las personas en sociedad, también para el desarrollo y funcionamiento de tejidos y órganos son cruciales ciertos vínculos entre partes de organismos vivos, que es posible asemejar a la comunicación humana. Podemos decir que las células se comunican entre sí y con el microambiente que las rodea. Por ejemplo, unas pueden indicarles a otras que se dividan, que crezcan o que se muevan enviándoles moléculas-señal que las células receptoras son capaces de captar e interpretar, y a cuya indicación, como consecuencia, responden.
Pero a diferencia de las personas, que solo disponen de unos pocos canales para comunicarse –la voz, el oído, la vista–, las células poseen miles de ellos, adaptados para captar distintos tipos de estímulos fisicoquímicos. En otras palabras, cuentan con una amplia variedad de receptores que les permiten captar señales bien distintas, aunque la maquinaria de procesamiento posterior de las señales suele ser común a muchos de esos receptores. Por esta razón, si esa maquinaria está ocupada interpretando determinados estímulos, puede carecer de la capacidad de interpretar otros que le están llegando. Siguiendo con el símil de la comunicación humana, en esa situación las células no solo oyen demasiadas voces: a su cerebro llegan más señales de las que logran procesar.
Cuando al receptor de estrógeno le llegan simultáneamente moléculas de estrógeno y de tamoxifeno, que transmiten a la célula indicaciones contradictorias, la respuesta final estará determinada por la cantidad de receptores a los que se unan una u otra de esas moléculas. Obedecer la señal química del estrógeno lleva a la célula a dividirse y proliferar; pero el tamoxifeno da la señal contraria, que se interpone en el camino de la del estrógeno. La respuesta final de la célula será una menor tasa de proliferación.
Esto no es todo, sin embargo.
Los sonidos que nos rodean
Igual que los sonidos de la calle, que a menudo dificultan hablar por el celular a quien lo intenta caminando por la ciudad, las células reciben estímulos que les llegan desde su microambiente, los cuales son captados por receptores distintos de los del estrógeno, pero pueden interferir en su respuesta a esa hormona o al tamoxifeno.
La matriz extracelular del tumor es así uno de los componentes fundamentales de la comunicación por la que las células intercambian señales con otras de su entorno, algo que hacen de manera constante y dinámica. Las células receptoras de esas señales pueden interpretarlas gracias a proteínas de su membrana –denominadas integrinas– que conectan directamente dicha matriz con su interior. Actualmente se sabe que las integrinas desempeñan un papel crucial en el desarrollo del cáncer y, en particular, del cáncer de mama. Por la vía de esa intercomunicación entre la célula y la matriz extracelular del tumor, suelen transmitir señales de proliferación, provenientes del microambiente tumoral, al interior celular.
Durante la formación de un tumor, se evidencia un incremento en la síntesis de proteínas por las células del microambiente tumoral. Por lo tanto, las señales que estas envían a las células del tumor también se hacen más intensas. En este contexto, gran parte de la maquinaria celular –comenzando por las integrinas– está ocupada interpretando las señales de la matriz extracelular del tumor, lo cual puede impedir que se comprendan otros mensajes. Por lo tanto, en un contexto tumoral de alta estimulación por la presencia de abundantes cantidades de señales de su matriz extracelular, el receptor de estrógeno, que interacciona con dichas integrinas, será incapaz de responder de forma normal a los estrógenos. Esto constituirá también una efectiva barrera a la terapia con tamoxifeno, ya que las señales que este transmite tampoco tendrán mayor efecto.
Esto significa que, si bien el tratamiento con tamoxifeno está dirigido a bloquear la supervivencia tumoral, su eficacia queda sujeta no solo a la presencia y abundancia de los receptores sino, también, a su disponibilidad para interpretar las señales de la droga.
¿Cómo podría lograrse que la célula responda más eficazmente al tamoxifeno y se supere la resistencia al tratamiento? Nuestro trabajo de investigación en el Instituto de Oncología Ángel Roffo y en la Facultad de Ciencias Exactas de la UBA procura dilucidar los mecanismos por los cuales, en las células tumorales mamarias, la matriz extracelular del tumor interfiere las señales químicas provenientes de factores de crecimiento, y cómo, a su vez, esto puede afectar la respuesta al tratamiento con tamoxifeno. Conociendo dichos mecanismos sería posible encontrar modos de lograr que el receptor de estrógeno no atendiera las señales de la matriz extracelular y quedara disponible para responder al tamoxifeno. Eso podría conseguirse, por ejemplo, con una molécula capaz de bloquear la comunicación entre el receptor de estrógeno y la integrina, la cual afectaría principalmente a las células tumorales y podría administrarse junto con el tamoxifeno. De ser viable, el camino conduciría a que el receptor de estrógeno, en presencia del fármaco, inhibiera el crecimiento tumoral.
En síntesis, para entender un proceso de desarrollo tumoral es necesaria una visión más integral, que considere no solo las células que constituyen el tumor sino, también, cómo se relacionan entre ellas y con su entorno.











