El 5 de junio de 1981 el Centro de Control de Enfermedades de Estados Unidos (CDC) publicó un informe en su reporte semanal de morbilidad y mortalidad (Morbidity and Mortality Weekly Report, una publicación de seguimiento epidemiológico en ese país). Allí señaló el hallazgo de ‘cinco casos poco frecuentes de neumonía en hombres gays’. Un mes después, el diario The New York Times informó sobre la aparición de casos de un tipo de cáncer inusual y particularmente agresivo en 41 varones homosexuales (figura 1).
Este sería el primer reporte de lo que más tarde se conocería como enfermedades asociadas al síndrome de inmunodeficiencia adquirida o sida, etapa final de la infección por el virus de la inmunodeficiencia humana (VIH) en ausencia de tratamiento. Recostada en una discriminación estructural, la comunidad médica asoció durante estos primeros años a la epidemia con poblaciones marginalizadas, principalmente varones homosexuales, contribuyendo a instalar una idea errónea del VIH como un virus que solo afecta a determinadas personas; aquello a lo que algunos autores llaman ‘ajenización’ de la infección.
¿DE QUÉ SE TRATA?
A propósito de un caso excepcional, ¿cuáles son las perspectivas y limitaciones en la búsqueda de una cura para la infección por VIH?

Afortunadamente, mucha agua ha corrido bajo el puente. Por un lado, los avances en el tratamiento antirretroviral combinado (o TARVc) lograron reducir drásticamente la morbilidad y mortalidad asociadas al VIH y al sida, transformándola en una infección controlable. A su vez, la toma de medicación diaria de forma sostenida –adherencia al tratamiento– permite reducir la cantidad de VIH circulante en plasma (carga viral) a niveles no detectables por las técnicas tradicionalmente empleadas. Así, el último hito de este largo camino se condensa en el concepto de indetectable = intransmisible (I = I), que implica que una persona con VIH que mantiene su carga viral indetectable por más de seis meses y una adherencia diaria a su tratamiento no puede transmitir el virus por vía sexual. Finalmente, el trabajo que diversos grupos de activistas han realizado para terminar con la epidemia
de la discriminación ha tenido un efecto drástico tanto en la percepción que la sociedad tiene de la infección como también en la calidad de vida de las personas con VIH.
Cabe mencionar la aprobación que obtuvo en la Argentina la Ley Nacional de Respuesta Integral al VIH, Hepatitis Virales, otras Infecciones de Transmisión Sexual (ITS) y la tuberculosis (TBC) el 30 de junio de 2022, proyecto desarrollado por numerosas organizaciones, con un foco en la eliminación del estigma y un enfoque basado en los derechos humanos.
A pesar de los avances en el desarrollo de antirretrovirales y las nuevas estrategias de prevención, como la profilaxis preexposición (PrEP, el uso de antirretrovirales de forma previa a una eventual exposición al virus) y posexposición (PEP, el uso de antirretrovirales luego de haber tenido una exposición al virus), sumado a indetectable = intransmisible, continúan existiendo numerosas barreras –desde económicas hasta sociales, asociadas al estigma–. Las dificultades en el acceso a la medicación, las fallas en el sistema de salud pública y la ineludible necesidad de tomar pastillas diariamente son obstáculos significativos en el día a día de una persona con VIH. Estas barreras se ponen en evidencia en las estadísticas año a año. Según el Programa Conjunto de las Naciones Unidas sobre el VIH y Sida (ONUSIDA), durante el año 2020 un millón y medio de personas contrajeron la infección por VIH y más de medio millón fallecieron por causas relacionadas al sida. A su vez, un reciente reporte del Unicef indica que durante el año 2020 una niña o un niño adquirió la infección por VIH cada dos minutos. Cabe destacar que el 89% de las nuevas infecciones pediátricas por VIH se concentraban en 2020 en el África subsahariana, donde se registraron el 88% de las muertes infantiles relacionadas con el sida. Mientras tanto, en América Latina, solo la mitad de esas infancias tienen acceso al tratamiento. Así, un enfoque basado en medicamentos no es suficiente para lograr mejoras en los indicadores de diagnóstico y tratamiento de VIH y sida, resultando necesario incorporar una mirada integral y centrada en las personas que viven con el virus, contemplando sus múltiples realidades socioeconómicas. Mientras tanto, la cura sigue siendo una necesidad imperiosa y un reclamo legítimo por parte del activismo.
¿Por qué es tan complejo encontrar una cura para el VIH? ¿Qué avances se lograron? Para entender esto, veamos con mayor detalle qué ocurre en nuestras células.
¿Qué ocurre cuando el VIH ingresa al cuerpo?
Como cualquier otro virus, el VIH utiliza para replicarse la maquinaria de la célula a la cual infecta. El abanico de células del sistema inmune que el VIH puede infectar es muy amplio, siendo su principal diana aquellas que presentan el receptor de membrana CD4: los linfocitos T CD4+, un tipo de glóbulo blanco fundamental en la defensa frente a infecciones. Luego de ingresar al linfocito, el material genético del virus (ácido ribonucleico, ARN) se retrotranscribe a ADN y se integra como ‘provirus’ al genoma del hospedador. Desde allí, puede iniciar su ciclo de replicación, llevando a la destrucción del linfocito y la generación de nuevas partículas virales que amplificarán la infección (figura 2).
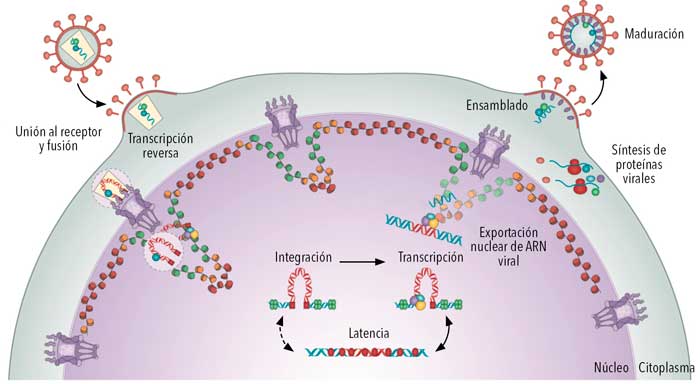
Con el correr de los años, la depleción progresiva y acumulada de linfocitos T CD4+ lleva a un cuadro de inmunodeficiencia generalizado característico de la etapa final de la infección (figura 3). El tratamiento antirretroviral combinado interrumpe la replicación viral bloqueando diversas etapas del ciclo y permite, en término de meses, recuperar el número de linfocitos T CD4+ y reducir la cantidad de partículas virales en plasma a niveles indetectables. Sin embargo, esto no implica la eliminación del virus, dado que –aun bajo tratamiento– el genoma puede permanecer en estado latente en algunas células: el genoma viral se integra al genoma de la célula, pero no produce nuevos viriones. Las células donde esto sucede constituyen los reservorios virales y representan el mayor obstáculo a la hora de eliminar la infección, ya que estos no son afectados por la terapia (figura 4).
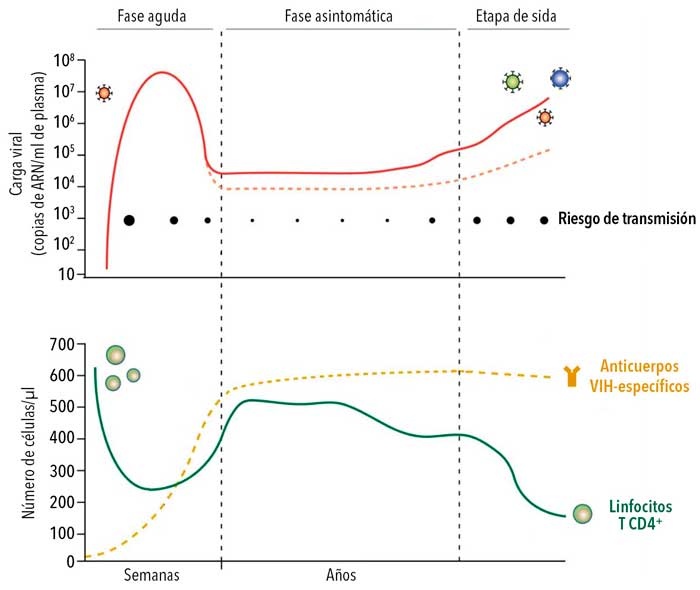
Si el tratamiento se interrumpe, el virus puede volver a multiplicarse produciendo un nuevo incremento de la carga viral (figura 5). Así, la administración de terapia antirretroviral de manera ininterrumpida y de por vida es indispensable, haciendo a la búsqueda de una cura una tarea ineludible.
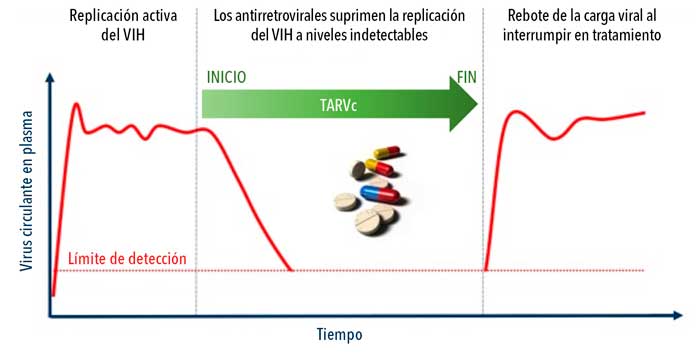
¿De qué hablamos cuando hablamos de ‘cura’?
Como con otras infecciones virales, resulta lógico asumir que una persona se encuentra curada cuando ya no hay rastros de virus en su cuerpo. Ahora bien, dada la existencia de reservorios virales, ¿es factible pensar en esta posibilidad? La respuesta podría encontrarse en los casos excepcionales de Timothy Ray Brown en Berlín y Adam Castillejo en Londres. Viviendo con VIH y como parte de un tratamiento para la leucemia, recibieron un trasplante de médula ósea con una particularidad: los donantes tenían una mutación homocigota en el gen CCR5, responsable de codificar otra proteína fundamental para el ingreso del VIH a las células. Usualmente, a los receptores de estos trasplantes se les realiza un pretratamiento con radiación o quimioterapia para evitar el rechazo y eliminar todo vestigio de células cancerosas. En este caso, esto implicó también la eliminación de las células que actuaban como reservorios virales. Luego de esta intervención, el sistema inmune de ambos individuos comenzó a repoblarse con células provenientes de la médula trasplantada que –al carecer del receptor CCR5– resultaron incapaces de ser infectadas por el VIH. Así, ambos pudieron abandonar el tratamiento sin sufrir un rebote en la carga viral. Algo similar se observó recientemente en una mujer de Nueva York, quien parece haber alcanzado la eliminación del virus a través de un trasplante de células de cordón umbilical. Si bien los grandes riesgos y costos hacen a estas estrategias impracticables a gran escala, son ejemplo de que una cura para la infección por VIH sería posible.
Sin embargo, no se trata de algo simple, empezando por la definición misma de cura, que ha sufrido diversas modificaciones. La Sociedad Internacional de Sida (IAS, por su sigla en inglés) establece que, de mínima, para que una intervención sea considerada una cura debe ser segura, efectiva, escalable y universalizable. Más precisamente, llama ‘remisión’ al control duradero del virus en ausencia de tratamiento, y ‘cura erradicativa’ a la eliminación de todas las células infectadas por VIH, lo que hasta ahora nunca fue alcanzado.
Cronología de una excepcionalidad
En 2013 una joven de la ciudad de Esperanza, Argentina, recibe una noticia inesperada: el resultado de su test de VIH resulta positivo, determinado por la presencia de anticuerpos contra el virus. Siguiendo el protocolo tradicional, se le realizó un análisis de carga viral para evaluar la cantidad de virus circulante en sangre. Este test de gran sensibilidad se realiza mediante la reacción en cadena de la polimerasa o PCR que permite detectar un número muy bajo de copias de ARN viral por mililitro de sangre y es un importante indicador del grado de multiplicación viral. Sorprendentemente, su nivel de carga viral resultó indetectable. Temiendo que se tratase de un error, las pruebas se repitieron en cuatro oportunidades, obteniéndose siempre los mismos resultados: en su sangre había anticuerpos contra el VIH pero ningún rastro de su material genético, manteniéndola sin un diagnóstico definitivo durante cuatro años. En 2017 ‘Esperanza’ –como decidiría ser llamada en la comunicación de su caso– se contacta con Natalia Laufer, médica infectóloga, investigadora del Conicet y especialista en ‘controladores élite’: aquel 1% de personas con VIH con capacidad de mantener una carga viral indetectable aun sin tratamiento. En conjunto con Gabriela Turk, conformaron el equipo de investigación del Instituto de Investigaciones Biomédicas en Retrovirus y Sida (INBIRS) que se dedicaría al estudio de su caso.
Luego de repetir los ensayos de PCR con un límite de detección aún menor y obtener los mismos resultados, las investigadoras decidieron buscar ya no el material genético de partículas virales libres, sino aquel integrado al genoma del huésped: el reservorio viral. Si bien por diversos factores –la mayoría desconocidos– los controladores élite pueden evitar que el virus se multiplique en su cuerpo, es posible encontrar en sus células ADN proviral completo y con capacidad de replicar en ensayos in vitro. Para evaluar esto en Esperanza, se enviaron 90 millones de células al laboratorio de Sharon Lewin, del Instituto Doherty en Australia, para la realización de ensayos de PCR de alta sensibilidad en búsqueda de diversas especies de material genético viral.
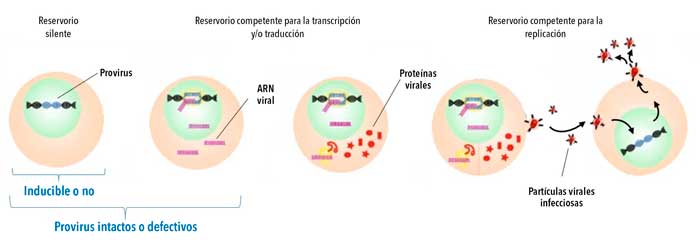
Para sorpresa de las investigadoras, fue imposible hallar siquiera una copia de ADN viral en todas las células analizadas. Evidentemente el caso de Esperanza era excepcional, pues presentaba características hasta ahora observadas únicamente en una mujer de San Francisco, en cuyas células no se halló virus intacto o con capacidad de multiplicarse (replicativamente competente, figura 6) sin requerir tratamiento antirretroviral. Al igual que Loreen Willenberg en San Francisco, Esperanza tampoco recibió un tratamiento, excepto durante un período del embarazo que cursó en 2019. Al cabo, mantuvo su carga viral indetectable luego de interrumpir la terapia y su bebé nació sin rastros de VIH.
Ahora bien, si en su plasma había anticuerpos, en algún lugar tendrían que encontrarse rastros del virus. Así, se amplió la búsqueda a un número exponencialmente mayor de células. Dada la imposibilidad de una extracción sanguínea tan grande, se le realizó una leucaféresis, técnica donde la sangre se hace circular a través de un dispositivo que extrae los glóbulos blancos para luego reingresar al torrente sanguíneo. A partir de esto, se purificaron más de 1500 millones de células que fueron enviadas al laboratorio de Xu Yu, de la Universidad de Boston, para que, de encontrarse material genético viral, determinase –mediante secuenciación genómica– si era intacto o defectivo (figura 6).
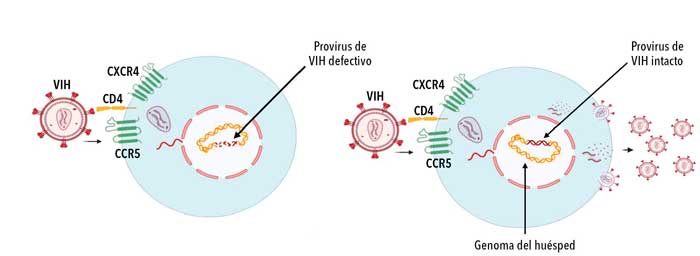
Los hallazgos surgidos de esta colaboración fueron publicados en la revista Annals of Internal Medicine. El resultado más importante de este trabajo determinó que dentro de esa enorme cantidad de células solo pudieron encontrarse siete copias de genoma viral, todas incompletas y con alta incidencia de mutaciones respecto del genoma de referencia; es decir, en teoría incapaces de replicar. Esto se comprobó mediante un ensayo de referencia en el cual se estimularon 150 millones de linfocitos T CD4+, sin hallar evidencia de virus replicativamente competente.
¿Podría esta bajísima proporción de células latentemente infectadas explicarse por cierta resistencia de los linfocitos a la infección? Para responder esta pregunta se evaluaron los niveles de los correceptores que usa el VIH para ingresar a las células, pero no se mostraron disminuidos. En línea con estos resultados, los linfocitos de Esperanza resultaron ser permisivos a la infección por VIH cuando se los expuso in vitro a tres variantes de virus, pudiendo completar una infección productiva dentro de sus células. Por último, al exponer a los linfocitos a fragmentos de partículas virales, se observó la presencia de memoria inmune celular.
Estas características permitirían pensar a Esperanza, al igual que la mujer de San Francisco, como un caso de ‘cura erradicativa’ ya que no parecería haber presencia de provirus con capacidad replicativa en sus células, algo solo observado anteriormente en los casos de Berlín, Londres y Nueva York.
Nuevas preguntas, perspectivas y limitaciones
Los principales interrogantes que surgen al analizar estos casos son los siguientes: ¿cómo fue posible? y, fundamentalmente, ¿cómo pueden ayudar a la búsqueda de una cura? Ambos están relacionados ya que, de dilucidar qué mecanismos permiten al sistema inmunológico de los controladores excepcionales contener la infección, podrían replicarse en otras personas con VIH. Sin embargo, averiguar esto es complejo ya que se cree que el control de la infección ocurre a tiempos tempranos. El caso de Esperanza evidencia esta primera limitación: su infección comenzó antes de 2013 y las primeras muestras de sus células pudieron ser analizadas recién en 2017. A pesar de esto, existen algunas hipótesis que intentan arrojar luz. La más aceptada postula que en los controladores élite ocurren tempranamente sucesivas rondas de selección donde células latentemente infectadas son reactivadas y eliminadas por el sistema inmune. Así, luego de mucho tiempo, solo permanecen en el cuerpo los linfocitos donde el provirus es defectivo o se encuentra integrado en zonas ‘silentes’ del genoma en donde no se expresa y, por ende, no se producen partículas virales (figura 4). Por qué estos procesos ocurren en tan pocos individuos, cómo sucede este control espontáneo o qué diferencia al sistema inmune de Esperanza respecto de otros controladores élite siguen siendo interrogantes abiertos.
Determinar de modo concluyente que se ha alcanzado una cura erradicativa conlleva importantes limitaciones tanto prácticas como epistemológicas. Por un lado, por la imposibilidad de analizar todas las células de una persona con VIH y, por otro, por la propia naturaleza falsable de la producción científica. Empíricamente, solo puede afirmarse que alguien no ha alcanzado una cura erradicativa mediante el aislamiento de virus replicativamente competente, algo que no pudo lograrse en este trabajo a pesar del astronómico número de linfocitos analizado. En otras palabras, la ausencia de evidencia de virus con capacidad de replicar no es evidencia de su ausencia.
Si bien no hay un único parámetro que permita explicar cómo se logra este control, el estudio de estos casos cobra relevancia y trae esperanza para el desarrollo de estrategias menos agresivas y con menores efectos adversos que, aunque no logren eliminar por completo el virus, permitan llegar a una remisión por tiempos prolongados sin la necesidad de un tratamiento antirretroviral.
Por último, el hecho de que Esperanza haya decidido mantener el anonimato –mencionando el peso del estigma que aún acarrea la infección– nos recuerda que, a cuarenta años del comienzo de la epidemia, no solo queda mucho trabajo por hacer en la búsqueda de una cura, sino también en la eliminación de la discriminación.
LECTURAS SUGERIDAS
ALIANZA MUNDIAL CONTRA EL ESTIGMA Y LA DISCRIMINACIÓN ASOCIADAS AL VIH-ARGENTINA, Muñoz M (coordinador para Argentina de la Alianza Mundial Contra el Estigma y la Discriminación Asociadas al VIH), 2022, ‘Cincuenta puntos clave para entender la Ley de Respuesta Integral al VIH, Hepatitis, Infecciones de Transmisión Sexual y Tuberculosis’. www.redtrasex.org/IMG/pdf/50puntosclave_leyvih2022.pdf
ASOCIACIÓN CICLO POSITIVO, 2020, ‘De Ushuaia a La Quiaca’. drive.google.com/file/d/1nMwWqI44R2tbAzGXYS0tzhsmQAWk81m8/view
MINISTERIO DE SALUD, 2021, Boletín N.° 38. Respuesta al VIH y las ITS en la Argentina, Buenos Aires.
MINISTERIO DE SALUD, 2017, ¿Qué piensan y hacen las personas ante el VIH y el sida?: un estudio sobre significados asociados al VIH y al sida en la población general en la Argentina, Dirección de Sida y ETS, Buenos Aires.
MINISTERIO DE SALUD, 2016, Vivir en positivo: guía para las personas con VIH, sus familiares y amigos, Dirección de Sida y ETS, Buenos Aires.
MINISTERIO DE SALUD Y DESARROLLO SOCIAL, 2019, Proyecto piloto de implementación de centros de prevención combinada y PrEP en la República Argentina: guía de directrices clínicas para equipos de salud, Dirección de Sida, ETS, Hepatitis y TBC, Buenos Aires.












