Morfogénesis: el origen de las formas
Sonic Hedgehog es una de las proteínas más importantes de la morfogénesis en el reino animal y toma su nombre de un popular erizo, protagonista de la serie de videojuegos de Sega Sonic The Hedgehog. El gen que codifica esta proteína fue descubierto por Christiane Nüsslein-Volhard y Eric Wieschaus en lo que se conoce como el ‘screening de Heidelberg’ y publicado en 1980 en la revista Nature. Este trabajo identificaba, en la mosca de la fruta, los genes cuyas mutaciones afectaban el número de segmentos y la polaridad de los embriones. La pérdida de función de Sonic Hedgehog ocasiona el reordenamiento de estructuras de su cutícula en forma de pequeñas ‘espinas’ (dentículos) hacia la zona media de su dorso, asemejándose a la cresta que posee el personaje del dibujo animado. Este hecho histórico le dio el nombre a la familia génica Hedgehog.
En animales vertebrados los Hedgehog forman una familia compuesta por tres genes que codifican tres proteínas: Sonic, Desert e Indian, que juntos son responsables de dar origen a numerosos órganos y extremidades. Así Nüsslein-Volhard y Wieschaus ganaron el premio Nobel en 1995 por contribuir con una respuesta a una de las preguntas más fundamentales de la biología del desarrollo: ¿cómo un óvulo fecundando de simetría simple y aparentemente homogéneo se desarrolla en un organismo diferenciado?
¿DE QUÉ SE TRATA?
Un grupo de células de simetría simple puede dar lugar a formas y patrones, mediante el establecimiento de gradientes de moléculas difusibles, para dar origen a un individuo complejo.
La morfogénesis es uno de los procesos más complejos que se pueda observar y es el área de estudio de la biología del desarrollo. El objetivo de esta disciplina es responder preguntas como cuáles son los mecanismos que dan origen a las formas biológicas o cuál es la relación entre los procesos de desarrollo y la información genética. Si bien en los últimos años se han dado varios pasos importantes, aún queda mucho por comprender. En este sentido, se han identificado dos mecanismos clave que contribuyen de manera orquestada a la morfogénesis: los procesos morfogenéticos y la formación de patrones espaciales. Los procesos morfogenéticos comprenden varios y diferentes fenómenos biológicos que van desde la multiplicación celular, pasando por la diferenciación, la migración, la adhesión diferenciada entre células y la apoptosis, que darán origen a la forma de un miembro, un órgano o un individuo completo a partir de una célula única. Cada uno de estos procesos está controlado por proteínas, llamadas morfógenos, distribuidas en el espacio y el tiempo en una forma muy precisa, y que conforman un patrón espacial inductivo. Los patrones espaciales de morfógenos pueden inducir, o no, procesos morfogenéticos dependiendo de la concentración local del morfógeno y de la capacidad de las células para ser sensibles a él. Como veremos más adelante, los patrones espaciales de proteínas se generan por la interacción entre genes y proteínas.
Los mecanismos que guían el proceso de formación de un individuo desde su concepción están programados en su genoma. Fallas internas en este programa llevan a malformaciones, muchas de ellas con destino fatal aun antes del nacimiento. El programa morfogenético puede fallar debido a mutaciones, es decir, a cambios en la secuencia de nucleótidos que conforman el material genético, o sea, el ADN. Estos cambios o mutaciones pueden estar asociados, para bien o para mal, a alteraciones en el fenotipo, llevando a una mayor diversidad en la población o a formas patológicas. Por otro lado, las malformaciones también pueden tener su origen en la interacción del programa morfogenético con agentes teratogénicos ambientales, tales como sustancias o radiaciones nocivas. En el próximo apartado presentamos un ejemplo ilustrativo de malformaciones en el rostro y el cerebro asociadas con el gen Sonic Hedgehog, a quien se lo identifica con la sigla en itálica Shh, y con su producto, la proteína Sonic Hedgehog, Shh.
La holoprosencefalia: del labio leporino a los cíclopes
¿Quién no conoce a una persona con labio leporino? Se trata de una alteración congénita que consiste en una división en el labio superior, que puede ser corregida en recién nacidos con cirugías para restaurar la apariencia y la función normal. El labio leporino es una de las alteraciones congénitas más frecuentes, representa alrededor del 15% de estas malformaciones, y muchas veces no tiene mayores consecuencias. Sin embargo, en algunos casos puede estar acompañado de otros trastornos congénitos más graves. Este defecto congénito está asociado a una serie de síndromes conocidos como holoprosencefalia (HPE), que afecta a 1 de cada 10.000 nacimientos. Sin embargo, es una de las malformaciones congénitas humanas más comunes y se estima que 1 de cada 200 abortos espontáneos son debido a formas graves de esta. La holoprosencefalia es una malformación cerebral congénita que resulta de una división incompleta del cerebro anterior o prosencéfalo. La división completa da origen a los dos hemisferios de nuestro cerebro y ocurre en el segundo mes de embarazo. La falla en este proceso de génesis del cerebro no solo afecta al cerebro anterior sino que también provoca anomalías faciales de diferente gravedad. De acuerdo con la gravedad de la holoprosencefalia, esta se clasifica en tres tipos principales: alobar, semilobar y lobar. Las formas menos graves pueden incluir un diente incisivo único central, displasia retiniana, obstrucción nasal y labio leporino. El labio leporino se puede presentar como una fisura única en el labio superior o como dos fisuras bilaterales. Con frecuencia se manifiesta con hendidura en el paladar. En general, la severidad del defecto facial depende de la gravedad de la malformación cerebral: en las formas menos graves, el cerebro se encuentra parcialmente dividido. En la forma semilobar el cerebro se divide solamente en la parte de atrás, pero no en la parte frontal. En el rostro pueden manifestarse labio leporino, hipotelorismo y/o microftalmia. Las formas más graves suelen ser en ocasiones fatales. En estos casos el prosencéfalo no se divide, no existe cuerpo calloso y el cerebro es pequeño. La forma alobar de holoprosencefalia está acompañada de defectos severos en el rostro, como ciclopía y proboscis.
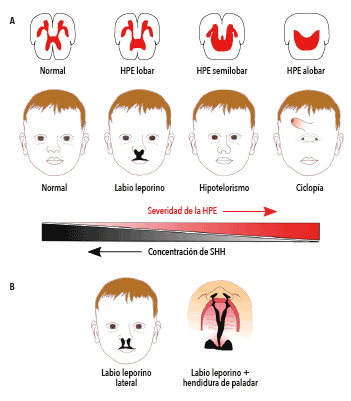
La severidad de la holoprosencefalia varía según la concentración de la proteína Sonic Shh; a menor concentración mayor gravedad en las anomalías (A). Los defectos en la formación del rostro están acompañados por malformaciones en el cerebro, en el caso grave, conocido como holoprosencefalia alobar, no hay división de hemisferios cerebrales. El caso leve más común de la holoprosencefalia es el labio leporino, que suele estar asociado con hendiduras en el paladar (B).
CÍCLOPES
Según la mitología griega, los cíclopes eran gigantes con un solo ojo en la mitad de la frente, hijos de dioses. Estos seres mitológicos llegan hasta nosotros a través de un relato de Homero, en la Odisea. Allí los presenta como pastores primitivos, malvados y torpes. En su relato, el cíclope Polifemo, hijo de Poseidón y Toosa, devoró a seis de los hombres de Odiseo y mantuvo al resto de la tripulación encerrada en una cueva con el objetivo de devorarlos cuando tuviese hambre. Este personaje de Homero ha sido desde entonces el arquetipo de monstruos para muchos cuentos infantiles. Sin embargo, este ser mitológico pudo haber tenido su origen en la realidad; en observaciones de nacimientos inusuales o el descubrimiento de cráneos con un único orificio ocular. Pasaron miles de años para entender que esta mítica malformación puede ser generada por una mutación o por un agente teratogénico. En 1957 varios ganaderos de ovejas de Idaho, Estados Unidos, se contactaron con el Departamento de Agricultura de su país cuando vieron que sus ovejas daban a luz corderos muertos con ciclopía. Fue el paso inicial del descubrimiento de una singular sustancia. Durante años los investigadores estudiaron la flora local para dar con la causa y el misterio fue resuelto en 1967 cuando encontraron una planta silvestre, llamada lirio de maíz (Veratrum californicum), que recreaba la misma deformación en ratones. Se determinó que la planta contiene un alcaloide con propiedades teratogénicas y que era el responsable de los defectos en los embriones de oveja. Fue llamado ciclopamina y estudios posteriores demostraron que interrumpe la vía de señalización del Sonic Hedgehog durante el desarrollo embrionario. Hoy en día, la ciclopamina está siendo estudiada como una droga en el tratamiento del cáncer.
Se ha establecido que la holoprosencefalia es una enfermedad genética compleja, resultado de la interacción de varios genes. Hoy se sabe que el origen de las malformaciones mencionadas está asociado con diferentes mutaciones, que afectan a cuatro genes conocidos (Shh, Zic2, Six3 y Tgif). Sin embargo, estudios genómicos más abarcativos realizados sobre grandes poblaciones de pacientes han identificado mutaciones adicionales en unos diez genes implicados en esta malformación. Una consecuencia común de las mutaciones asociadas a estos genes es la disminución de la expresión del gen Shh. Esto sugiere que el defecto en la región rostro-ventral del embrión asociado a la holoprosencefalia es consecuencia de la disminución en la tasa de síntesis de la proteína Sonic Hedgehog.
Las mutaciones y las fallas en los programas morfogenéticos
Diversos estudios en biología del desarrollo muestran que existe una estrecha relación entre los procesos morfogenéticos y la información almacenada en el genoma de un organismo. Existen diferentes mecanismos moleculares por los cuales aun pequeños cambios en el genoma pueden causar una falla en el programa morfogenético. Sabemos que los genes guardan la información para que las células fabriquen las proteínas necesarias para realizar las funciones celulares. Para entender el efecto de tales cambios o mutaciones en el genoma, debemos repasar cómo es el procesamiento de esta información y cómo se realiza la síntesis proteica. La información está guardada en los codones del gen y es copiada en el núcleo de la célula a un mensajero en un proceso llamado transcripción. Luego, la información presente en la secuencia de nucleótidos del mensajero es usada para construir una cadena de aminoácidos en un proceso conocido como traducción del mensajero. Los encargados de identificar los codones y asignar el aminoácido son los ribosomas a través de un proceso altamente complejo. Paso a paso los ribosomas interpretan cada uno de los codones en el mensajero que está siendo traducido y van colocando el aminoácido que corresponde, según el código genético, en el extremo de la cadena de aminoácidos que se está construyendo, como si fueran cuentas en un collar. Esta cadena se va plegando sobre sí misma en una estructura tridimensional precisa, dando lugar a la proteína.
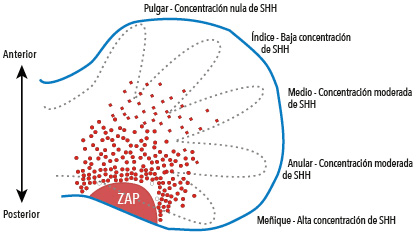
El gen Sonic Hedgehog codifica la información para sintetizar la proteína del mismo nombre. Durante el desarrollo de la mano, Sonic Hedgehog se produce en células ubicadas en la zona de actividad polarizante (ZAP). Desde allí difunden formando un gradiente y proporcionando información posicional a las células del tejido. Esto les otorga las identidades a los diferentes dígitos. Por ejemplo, el pulgar queda determinado por concentración nula de Sonic Hedgehog, mientras que el dedo meñique surge en la región de mayor concentración Sonic Hedgehog.
Entendiendo esto es posible imaginar cómo algunas mutaciones pueden ocasionar fallas en el programa morfogenético y llevar a la holoprosencefalia. Por ejemplo, puede existir una mutación de un único nucleótido en una región codificante de un gen que modifica el codón asociado. Si el nuevo codón, según el código genético, codifica para un aminoácido diferente, esta es llamada mutación con cambio de sentido. Pero si el codón resultante de la mutación codifica para el mismo aminoácido estamos ante una mutación sinónima, también llamada ‘silenciosa’ porque se espera que no tenga ningún efecto en la proteína. Hoy se conocen varias mutaciones con cambio de sentido en el gen Six3 asociadas a la holoprosencefalia. Este gen codifica una proteína que tiene por función regular la expresión de Shh, es decir, controlar la tasa de síntesis de la proteína Shh. Estos resultados sugieren que la sustitución de aminoácido derivada de esta mutación disminuye la habilidad regulatoria de Six3 sobre el gen Shh. Por otro lado, mutaciones en las regiones que no codifican proteínas también pueden llevar a fallas del programa morfogenético. En este sentido, se ha identificado que una mutación distante a casi 500.000 nucleótidos del gen Shh reduce la habilidad con que la proteína asociada al gen Six3 se une al sitio regulador de Shh en el ADN. La consecuencia de esta mutación es también una disminución de la proteína Shh y el desarrollo de holoprosencefalia leve.
En un estudio reciente se identificaron ocho nuevas mutaciones en el gen Shh asociadas con casos leves de holoprosencefalia. Lo interesante y novedoso en este caso es que estas mutaciones son del tipo ‘silenciosas’. Resultan de la degeneración del código genético: dado que el código genético presenta 64 codones y solo 20 aminoácidos, existen diversos codones que corresponden al mismo aminoácido. Si una mutación resulta en un codón sinónimo, no habrá cambio en la cadena de aminoácidos y no es esperable que causen efectos en el fenotipo. ¿Por qué entonces una mutación sinónima, que no cambia la secuencia de la proteína, puede tener consecuencias? Después de todo, parece que estas mutaciones sinónimas no son tan silenciosas como se pensaba.
Una respuesta a esta pregunta considera que durante el proceso de síntesis de proteína esta se va plegando sobre sí misma y en este proceso es muy importante la velocidad con que los aminoácidos son agregados a la cadena de aminoácidos y con la que el ribosoma va liberando la proteína naciente. Parece que el ribosoma lo hace más rápido en algunos codones que en otros. Según una teoría reciente, esta velocidad está codificada en los pares de codones en una suerte de mensaje subliminal. Si bien las mutaciones sinónimas no alteran la secuencia de aminoácidos, estas pueden alterar el patrón de velocidad requerido para el plegamiento normal de la proteína. Las proteínas mal plegadas son degradadas. Esta disminución en la cantidad de proteínas puede llevar a diversos rasgos clínicos patológicos, como es el caso particular de la holoprosencefalia. Así, el hallazgo de las mutaciones silenciosas parece confirmar la teoría de que las mutaciones sinónimas tendrían un papel importante en la velocidad de síntesis y pueden llevar a un plegamiento incorrecto.
Los ejemplos mencionados ilustran algunos de los mecanismos por los cuales pequeñas variaciones en el ADN conducen a fallas en el programa morfogenético. También ilustran cómo los programas morfogenéticos están incrustados en el orden preciso de los nucleótidos que conforman el genoma.
Morfógenos y patrones de Turing
El gen Shh juega un papel fundamental en el desarrollo de todos los bilaterios, dado que es uno de los genes claves para crear la polaridad, es decir las diferencias entre los extremos de un apéndice, de un órgano, o de un segmento del embrión. Como vimos, es clave en la formación del rostro y la división de los hemisferios cerebrales. Además, también participa en el desarrollo de las extremidades, donde influye en los destinos celulares a lo largo del eje anterior-posterior. Así, el pulgar se forma a partir de las células que han recibido una menor concentración de Shh, mientras que el dedo meñique surge en la región donde Shh es producida y por lo tanto está presente en una mayor concentración. Shh es producida por las células que están en una región y secretada al medio donde difunde. El proceso de difusión genera un gradiente de moléculas que brinda información posicional, capaz de inducir cambios celulares en zonas específicas. La capacidad de difundir y orientar espacialmente los procesos morfogenéticos define a los morfógenos y Shh es uno de los más estudiados de ellos. Curiosamente el término morfógeno fue acuñado por el matemático Alan Turing en 1952 en su trabajo La base química de la morfogénesis, quien formuló el primer mecanismo que permitiría responder la difícil pregunta enunciada anteriormente: ¿cómo un grupo de células de simetría simple puede dar lugar a un individuo complejo?
La pregunta acerca del mecanismo de formación de patrones más allá del simple gradiente tiene una larga tradición en los modelos matemáticos de la biología del desarrollo, y el modelo presentado por Turing es un capítulo importante de la historia. En su trabajo, Turing desarrolló la idea de que para que surjan patrones biológicos a partir de un estado inicialmente homogéneo debían existir dos o más morfógenos. Uno de ellos, el activador, debe aumentar la concentración de los morfógenos, mientras que la acción del otro morfógeno, el inhibidor, impide la producción de ambos. Otra condición importante es que los dos morfógenos deben difundir con velocidades diferentes. Estos procesos de reacción y de difusión ocurren en simultáneo y se representan matemáticamente por medio de las llamadas ecuaciones de reacción-difusión. Turing mostró que la distribución espacial de los morfógenos no es uniforme, sino que presenta diferentes patrones, que fueron llamados patrones de Turing. Estos patrones, tales como bandas periódicas, puntos, espirales o incluso patrones más complejos, son observados en muchos ejemplos de la naturaleza. La idea de Turing de que la difusión de dos morfógenos lleva a la formación de patrones espaciales puede resultar contraintuitiva ya que la difusión, por sí sola, está asociada a la tendencia hacia una distribución espacial homogénea. Por lo tanto, pensar que la difusión puede generar un patrón a partir de algo inicialmente homogéneo es bastante original. Los patrones de Turing son un increíble ejemplo de autoorganización en los sistemas biológicos.
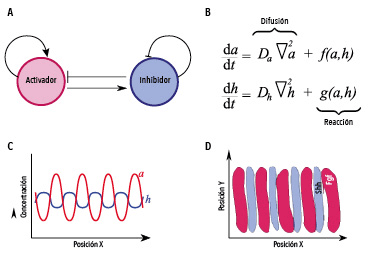
Los patrones inductivos se pueden formar por un mecanismo de autoorganización propuesto por Turing en 1952. Él determinó en qué condiciones un sistema formado por dos morfógenos (A), un activador (círculo rojo) y un inhibidor (círculo azul) era capaz de formar patrones estables. Las concentraciones del activador (a) y del inhibidor (h) evolucionan en el tiempo y en el espacio según un sistema de ecuaciones diferenciales parciales llamadas de reacción-difusión (B), donde las funciones f y g representan la forma en que los morfógenos son activados e inhibidos. Si el morfógeno activador difunde más lentamente que el inhibidor (Da < Dh), se producen bandas alternadas de activador e inhibidor (C). En el caso de las bandas observadas en las rugas palatinas (D) se determinó que el morfógeno activador (bandas rojas) es Fgf (factor de crecimiento de fibroblastos), mientras que el inhibidor es Shh (bandas azules).
Un sistema experimental donde el gen Shh interviene a través del mecanismo de Turing es en la formación de las rugas palatinas. Estas rugas son estructuras en relieve que se encuentran en el paladar y que tienen funciones relacionadas a la masticación y a la percepción del sabor. En humanos, se forman durante las semanas 12.a y 14.a del embrión y permanecen estables durante toda la vida del individuo, por lo que se pueden usar como un identificador forense. Hay evidencias de que las rugas palatinas en mamíferos son formadas por un mecanismo de Turing donde el morfógeno conocido como Fgf actúa como morfógeno activador y Shh, como inhibidor. Así, mientras el paladar crece en tamaño, un patrón de bandas paralelas con alto contenido de Shh se forma y define la posición de las rugas.
El tamaño característico de los patrones de Turing depende de los parámetros cinéticos del sistema. En un trabajo reciente se mostró que el número de dígitos en una mano está bajo un control fino de la concentración de morfógenos. Las alteraciones en la regulación de los procesos donde intervienen estos morfógenos origina la aparición de polidactilia. Esto demuestra que una de las propiedades clave del mecanismo propuesto por Turing, es decir que el tamaño del patrón, o el número de dígitos observados, depende de las tasas de producción de los morfógenos. El hallazgo de sistemas experimentales como el desarrollo de las rugas del paladar o de las extremidades, que satisfacen el mecanismo de Turing, ha aumentado en gran medida la aceptación de este modelo en la comunidad de biología del desarrollo.
En conclusión, la liberación, difusión e interacción de los morfógenos permiten la formación de patrones complejos, algunos de los cuales están a la vista de todos y otros pueden ser observados experimentalmente. Estos patrones controlan de forma coordinada en el tiempo y el espacio procesos celulares que dan lugar a las formas. Por otro lado, las malformaciones congénitas nos dan pistas acerca de los actores principales involucrados en el desarrollo, que está programado en el genoma de cada organismo.
GLOSARIO
Apoptosis. Es la muerte celular programada. La célula recibe una señal inductiva que desencadena una serie de procesos bioquímicos que conducen a la degradación de sus componentes para que sean reutilizados por el organismo. Es un mecanismo que permite eliminar células en exceso, sea para mantener la población celular controlada o para generar formas durante el desarrollo de los organismos. Además, es utilizado para destruir células dañadas.
Bilaterios. Son los animales cuyo cuerpo es simétrico respecto del plano sagital, por ende las dos mitades en que divide este plano resultan idénticas frente a una reflexión especular. Los humanos son bilaterios y por ello cada mano es la reflexión especular de la otra.
Cambio de sentido. Son las mutaciones en un único nucleótido que provocan la aparición de un codón que codifica para un aminoácido diferente, dando lugar a una modificación en la proteína resultante.
Ciclopía. Es una malformación congénita que da lugar a un individuo con un ojo único posicionado en el centro del rostro. Esto recuerda a los cíclopes de la mitología griega, de donde recibe su nombre. Esta alteración congénita ocurre en los casos graves de holoproencefalia alobar y es muy poco frecuente.
Codón. Es una secuencia de tres nucleótidos del ADN que codifica un aminoácido, según una relación que está determinada por el código genético. Las posibles combinaciones de los 4 nucleótidos (A, T, C y G) en cada una de las tres posiciones del triplete generan 64 codones distintos (64 = 4 × 4 × 4). Como existen solamente 20 aminoácidos, varios codones diferentes codifican para el mismo aminoácido, por lo cual decimos que el código genético es redundante o degenerado.
Difusión. Es un proceso debido al movimiento al azar de las partículas por el cual se establece un flujo de partículas desde una zona de alta concentración a otra de menor concentración.
Fenotipo. Conjunto de características observables que un individuo presenta como resultado de la interacción entre su genotipo y el medio (fenotipo = genotipo + ambiente). El genotipo está determinado por el ADN.
Gradiente (de concentración). Es una magnitud que describe la proporción y la dirección en la que se produce el mayor cambio en la concentración. Esta magnitud existe siempre que la concentración no sea uniforme en el espacio. La difusión ocurre en la dirección opuesta al gradiente.
Hipotelorismo. Es una malformación cráneo-facial congénita caracterizada por la disminución de la distancia entre los globos oculares.
Mensajero. También llamado ARN mensajero o ARNm. Es una copia de una parte de la secuencia de nucleótidos del ADN, generada durante el proceso de transcripción del gen. Contiene la información necesaria para que el ribosoma sintetice una proteína, funcionando como un intermediario entre el ADN y el ribosoma.
Microftalmia. Es un defecto cráneo-facial congénito que se manifiesta con globos oculares de tamaño menor que lo normal.
Mutaciones. Cualquier cambio en la secuencia de nucleótidos del ADN. Un ejemplo de mutación es el cambio al azar en un nucleótido dado, o la inserción de un nucleótido en la secuencia de ADN.
Nucleótidos. Son las moléculas que forman el ADN y el ARN. Los nucleótidos forman cadenas lineales y pueden ser miles o millones, dependiendo del organismo. También realizan funciones como moléculas libres en las células. Los nucleótidos que forman el ADN son identificados por su base nitrogenada, que puede ser adenina (A), timina (T), citosina (C) o guanina (G).
Polidactilia. Es una malformación congénita que se manifiesta por dedos supernumerarios en manos o pies, generalmente uno más que lo normal.
Proboscis. Es una estructura tubular de tejido sin orificio que resulta de una malformación nasal y que suele acompañar a la ciclopía en los casos graves de holoproencefalia alobar, situándose por encima del ojo único.
Prosencéfalo. Es la estructura embrionaria del sistema nervioso central que da origen al lóbulo frontal del cerebro del feto. También se lo conoce como cerebro primitivo anterior. La división del prosencéfalo durante la gestación da lugar a la formación de los nervios ópticos, los hemisferios cerebrales y otras estructuras, como el tálamo y el hipotálamo.
Ribosoma. Máquina molecular responsable por la síntesis de proteínas a partir de la información del mensajero, en un proceso conocido como traducción. La secuencia de nucleótidos del mensajero determina la secuencia de aminoácidos de la proteína. Los ribosomas están presentes en todas las células a excepción de los espermatozoides.
Teratogénico. La palabra proviene del griego terato, que significa monstruo. Un agente teratogénico es capaz de provocar un defecto durante la gestación. Los agentes teratogénicos pueden provocar alteraciones morfológicas, retraso en el crecimiento, alteraciones funcionales y muerte embrionaria. Ejemplos de agentes teratogénicos son algunas sustancias químicas, algunos virus y las radiaciones, entre otros. La gravedad de las alteraciones depende de factores como la dosis del agente y la edad gestacional.
LECTURAS SUGERIDAS
Economou AD, Ohazama A, Porntaveetus T, Sharpe PT, Kondo S, Basson MA, Gritli-Linde A, Cobourne MT & Green JB, 2012, ‘Periodic stripe formation by a Turing mechanism operating at growth zones in the mammalian palate’, Nature Genetics, 44: 348-351.
Kim A & cols., 2020, ‘Synonymous variants in HPE alter codon usage and impact the Sonic Hedgehog protein’, Brain, e/p, DOI 10.1093/brain/awaa152
Kondo S & Miura T, 2010, ‘Reaction-diffusion model as a framework for understanding biological pattern formation’, Science, 329: 1616-1620.
Marcon L & Sharpe J, 2012, ‘Turing patterns in development: What about the horse part?’, Current Opinion in Genetics & Development, 22: 578-584.
Salazar-Ciudad I, Jernvall J & Newman S, 2003, ‘Mechanisms of pattern formation in development and evolution’, Development, 130: 2027-2037.
Yongsu J & cols., 2008, ‘Regulation of a remote Shh forebrain enhancer by the Six3 homeoprotein’, Nature Genetics, 40: 1348-1353.













