En octubre de 2019, Netflix estrenó Unnatural Selection, una serie documental de cuatro capítulos dedicada a la edición génica, particularmente a una forma de ella que se vale de CRISPR (sigla de Clustered Regularly Interspaced Short Palindromic Repeats). Los CRISPR son secuencias de ADN del genoma de bacterias y otros organismos procariotas previamente infectados por un virus que se reproduce en ellos. Entre otras cosas, los CRISPR sirven para detectar y destruir el virus en infecciones siguientes. Apelando al testimonio de científicos, médicos y pacientes, la serie se detiene en los alcances y las posibilidades de la técnica, especialmente en el área de la salud humana.
Por su lado, Cas9 (que viene de CRISPR-associated protein 9) es una enzima que se vale de los CRISPR como guía para reconocer y cortar secuencias específicas de ADN complementarias de las de CRISPR. Los sistemas CRISPR constituyen un componente fundamental del sistema inmune bacteriano en su combate contra infecciones virales, pues el grupo de secuencias de ADN bacteriano que los componen actúan ante dichas infecciones. Una infección viral ocurre por la inserción de una secuencia de ADN viral en el genoma bacteriano; cuando eso sucede, la bacteria genera secuencias de ARN con fragmentos complementarios del ADN viral, los que se asocian con proteínas de las bacterias, es decir, con la enzima Cas9, y forman el complejo CRISPR-Cas9. Al cortar el ADN viral en la zona donde se ha insertado, la enzima Cas9, que es una nucleasa, elimina la posible infección.
El sistema CRISPR fue descripto por primera vez en por Yoshizumi Ishino, de la Universidad de Osaka, en 1987. Lo hizo trabajando con la bacteria Escherichia coli. En 2005, el microbiólogo español Francisco Mojica, de la Universidad de Alicante, abrió el camino para su uso como técnica de edición en biotecnología. En 2012, la bioquímica estadounidense Jennifer Anne Doudna, profesora de la Universidad de California en Berkeley, y la microbióloga francesa Emmanuelle Charpentier, hoy directora del Instituto Max Planck para Biología Infectiva de Berlín y en ese momento en la Universidad de Umeå, en Suecia, anunciaron la posibilidad de dirigir el sistema de CRISPR-Cas9 al lugar del genoma que se desee. Es el momento en el que comienza a contarse con esa herramienta para la edición génica, algo que se ha llamado la ‘revolución CRISPR’.
Kevin Esvelt, un biólogo estadounidense doctorado en Harvard y profesor en el Instituto de Tecnología de Massachusetts (MIT), lidera en esta segunda universidad el proyecto Sculpting Evolution (‘Esculpiendo la evolución’), que aplica la técnica CRISPR-Cas9 para actuar sobre los ecosistemas y, por ejemplo, producir alimentos genéticamente modificados a bajo costo.
En 2018, Esvelt estuvo de visita en Buenos Aires y fue entrevistado por Omar Coso para el programa ToquinTEC, uno de los programas de divulgación científica del canal de televisión TECtv, perteneciente al Ministerio de Ciencia, Tecnología e Innovación de la Nación. Dicho programa consiste en entrevistas a científicos realizadas por otros científicos. El entrevistador es doctor y profesor de la UBA (biología), investigador del Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE) UBA-Conicet.
Si hay algo que define a Esvelt es la pasión por su labor. Relata que desde siempre estuvo interesado en la ciencia, pero esa pasión nació cuando visitó las Galápagos y se maravilló con la diversidad de especies, tan diferentes y a la vez tan similares. Ello lo llevó a adentrarse en la obra de Charles Darwin (1809-1882), para quien una visita a las Galápagos le proporcionó uno de los grandes impulsos que lo condujeron a formular la teoría de la evolución por selección natural. Hoy Esvelt se considera un ingeniero evolutivo porque su interés mayor es trabajar con la edición génica como herramienta para modificar ecosistemas. En su laboratorio pone en marcha con sus colaboradores procesos similares a los de la evolución natural, que genera nuevos rasgos en los organismos.

–¿Qué me puede decir del trabajo sobre la evolución que realiza con el grupo llamado Sculpting Evolution?
–La evolución es un proceso maravilloso mediante el cual no se necesita entender algo para usarlo. Las cosas que evolucionaron fueron siempre difíciles de comprender. Si tomamos como ejemplo el caso de una proteína, todavía no podemos predecir cómo se plegará, pero si creamos un millón de copias y las probamos todas, podremos seleccionar la que hace lo que queremos y replicarla un millón de veces. Aunque no entendamos cómo se pliega o cómo realiza su actividad molecular, podremos igual crear una molécula que haga lo que buscamos. La evolución es como una caja negra en la que ponemos algo, regulamos los parámetros y vemos qué sale. No entendemos cómo fue, pero creamos herramientas útiles. A esto me refiero cuando hablo de aprovechar la evolución. Necesitamos modelar el ambiente para seleccionar las propiedades que queremos.
Para Esvelt, el CRISPR es una de las cuatro herramientas primordiales de la biología molecular y de la biotecnología, junto con la técnica de replicar el ADN, la capacidad de leerlo y la de generarlo a partir de una secuencia determinada. El CRISPR permite, entre otras cosas, cortar con precisión cualquier secuencia de ADN de cualquier organismo vivo y reemplazarla con otra, o desactivar un gen, es decir, suprimir su expresión. El campo de acción del CRISPR es vasto, pues se puede aplicar para fines académicos, por ejemplo, para entender las funciones de genes, o en medicina para terapias génicas, así como para propósitos industriales, entre ellos generar productos alimentarios mejorados.
–CRISPR le permitió editar genes en un microorganismo en su laboratorio, pero usted habla de diseñar herramientas para modificar ecosistemas. ¿Cómo pasamos de una placa de Petri a un ecosistema?
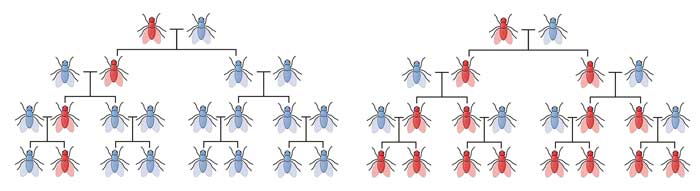
–Es una gran pregunta. Y todo se resume en la selección natural. Cuando diseñamos un organismo, lo cambiamos para nuestro beneficio, no para beneficio del organismo. Cuando alteramos organismos y los liberamos a la naturaleza, no les va tan bien como a los organismos salvajes. Y no podemos alterar el ecosistema. O, por lo menos, no hasta hace poco. Supongamos que, en lugar de usar CRISPR para editar un gen y reemplazarlo con una nueva versión en solo una generación de organismos, insertamos la nueva versión del gen y las instrucciones para hacer CRISPR, y le indicamos que realice ese cambio en generaciones futuras. Tendremos, así, un organismo con la capacidad de editar por su cuenta su genoma. Si ese organismo se aparea con uno silvestre, la descendencia recibirá una versión original y una nueva del gen que hemos manipulado. El sistema CRISPR cortará la versión original y la reemplazará por la nueva. La siguiente generación tendrá dos versiones nuevas de ese gen, las que continuarán heredándose de allí en más. Logramos así que un organismo edite su genoma sin intervención humana directa.
Mediante esta herramienta, Esvelt trabaja en genética dirigida (en inglés, gene drive), la cual consiste en generar un conjunto de genes y propagarlo en una población silvestre para modificarla. En su caso particular, se ocupa de plagas, parásitos o insectos vectores de enfermedades, en busca de mitigar sus efectos.
Entiende que la actividad científica debe procurar resolver situaciones problemáticas, por lo cual gran parte de su labor consiste en un constante intercambio de información y opiniones con la comunidad, para tratar de entender sus problemas. Eso es lo que llama ‘participación ciudadana’.
LAS CONSECUENCIAS DE LARGO PLAZO DE LA GENÉTICA DIRIGIDA
Como en muchos otros casos, el uso de las técnicas de edición de genes se expandió tan rápidamente que las inquietudes éticas sobre su utilización se plantearon cuando esta ya había comenzado y no existía mayor experiencia sobre las repercusiones de largo plazo de los cambios que provocaría. Si bien es cierto que con el avance tecnológico las posibilidades de obtener modificaciones no deseadas o con efectos secundarios perjudiciales disminuyó considerablemente, no es menos cierto que toda alteración de los ecosistemas puede llevar a cambios absolutamente inesperados y deberían ser no solo condenados sino prohibidos en cualquier situación o convención de ética ambiental. Por otro lado, dada la complejidad de los ecosistemas y de los mismos organismos, predecir las consecuencias de alterar un gen específico de una especie particular una vez devuelta a la naturaleza es prácticamente imposible: gran parte de las características de los seres vivos dependen de la acción de varios genes, de factores epigenéticos y de la influencia del ambiente. Esto demuestra la necesidad de someter la investigación y sobre todo las aplicaciones tecnológicas de la genética dirigida a las salvaguardas éticas que se aplican en otras áreas relacionadas con la genética o en ámbitos de la medicina.
–¿Qué trabajos está encarando con la participación ciudadana que menciona?
–Comenzamos un proyecto piloto en las islas Nantucket y Martha’s Vineyard, en la costa de Massachusetts, en las cuales el 40% de los residentes permanentes sufren ciertas enfermedades propagadas por garrapatas. Sucede que la gente traza caminos en los bosques en cuyos bordes crece el pasto; esto atrae a venados y ratones que se alimentan con él, y ambos animales alimentan a las garrapatas, que los muerden y también muerden a personas. Que haya más ratones y venados significa que habrá más garrapatas, y cuando estas muerden a un roedor enfermo se convierten en vectores que transmiten el organismo patógeno al ser humano.
–¿Cómo planea usar CRISPR en ese caso?
–Inmunizando a todos los ratones para que no puedan enfermarse. Con el tiempo, los roedores generan inmunidad, como lo hacemos nosotros, pero no es una característica heredable. Por ende, queremos identificar los anticuerpos generados por los ratones y los genes asociados con ellos para insertarlos por CRISPR en el genoma del ratón y obtener que estén en sus células reproductivas. De esa manera pasarían a la descendencia y le conferirían inmunidad.
Este caso de participación comunitaria se puso en marcha en 2017 con el nombre Mice against ticks (ratones contra garrapatas). En la Argentina, quienes trabajan con CRISPR lo hacen tanto en la industria alimentaria, por ejemplo, sobre la papa producida por INTA, como en el campo de la salud. En este se puede citar al gusano barrenador del ganado (Cochliomyia hominivorax), un díptero que crea un problema sanitario en diversos países sudamericanos: las hembras depositan sus huevos en heridas de los animales, de cuyos tejidos se alimentan las larvas. En Norteamérica el trastorno fue eliminado generando miles de moscas estériles y liberándolas al ambiente, con el propósito de que su cruza con sus pares silvestres no produjese descendencia. Eso sería más difícil de lograr en Sudamérica, debido a condiciones ambientales, en particular la enorme diversidad de ecosistemas, que requeriría mucho personal científico y técnico, y dificultaría la estandarización de los procesos. Por esto, Esvelt entiende que sería mejor valerse de la genética dirigida.
En síntesis, CRISPR es un logro científico de magnitud y tiene aplicaciones de interés mundial. Desde que comenzaron estas, allá por 2012, la cantidad de investigaciones que se pusieron a trabajar en ellas ha ido creciendo de manera exponencial. Todo indica que esa tendencia continuará.
La entrevista completa puede verse en www.youtube.com/watch?v=YoYrcZjL_wQ
Lecturas sugeridas
ESVELT K et al., 2014, ‘Concerning RNA-guided gene drives for the alteration of wild populations’, eLife, 3: e03401. Accesible en www.ncbi.nlm.nih.gov/pmc/ articles/PMC4117217/
OYE K et al., 2014, ‘Biotechnology: Regulating gene drives’, Science, 345, 6197: 626-628.










