La enfermedad COVID-19 (siglas del inglés CoronaVirus Disease 2019) causada por el nuevo coronavirus SARS-CoV-2 (del inglés, Severe Acute Respiratory Syndrome CoronaVirus 2) ha afectado a millones de personas en todo el mundo, promoviendo un esfuerzo sin precedentes de la comunidad científica para comprender esta enfermedad. Las presentaciones clínicas de la COVID-19 son muy variables, con aproximadamente 80% de los infectados sin síntomas o con solo síntomas leves, mientras que alrededor de 20% sufren las formas más graves asociadas a neumonía, insuficiencia respiratoria y en algunos casos la muerte.
La función del sistema inmunológico es defendernos contra los agentes extraños y, al mismo tiempo, mantener bajo control cualquier proceso donde la respuesta inmune se dispara, manteniendo así la homeostasis, es decir, la armonía del organismo.
Hoy sabemos que el virus SARS-CoV-2 infecta a las células del sistema respiratorio, en un proceso infeccioso que puede provocar síntomas similares a una gripe, aunque, como este virus es hábil para alterar la respuesta inmunológica que él mismo gatilla, esta puede, si se descontrola, desencadenar daño en el tejido pulmonar. Esto último ocurre en un pequeño porcentaje de pacientes, en quienes esta reacción de su propio sistema inmunológico es exagerada.
En esta revisión exploraremos los mecanismos inmunológicos descriptos hasta hoy que están involucrados en la defensa contra SARS-CoV-2 y que, en la gran mayoría de las personas infectadas lleva a su recuperación y cura, pero que en otras puede contribuir a su muerte.
¿DE QUÉ SE TRATA?
¿Cuál es el papel del sistema inmunológico en COVID-19? ¿Cuáles son los mecanismos inmunológicos que nos defienden de SARS-CoV-2? ¿Por qué algunas personas llegan a una COVID-19 severa?
SARS-CoV-2: el virus que nos cambió la vida
Los virus son agentes infecciosos incapaces de sobrevivir y reproducirse por sí mismos; necesitan ingresar al interior de una célula anfitriona para ejecutar sus funciones. Una vez que ingresan o infectan a esta célula, se multiplican en su interior, hasta que la célula eclosiona expulsando las nuevas partículas virales al exterior, listas para infectar nuevas células.
El SARS-CoV-2 está compuesto por una molécula de ácido ribonucleico (ARN, la molécula que contiene la información genética del virus) en una envoltura lipoproteica de aproximadamente 100nm de diámetro, esto es, veinte veces más pequeño que una bacteria promedio. Su superficie está cubierta de proteínas llamadas spike (en castellano, espiga) o simplemente proteínas S, que forman una corona que le da al virus su nombre. SARS-CoV-2, como tantos otros virus respiratorios, ingresa a nuestro cuerpo principalmente a través de las mucosas que tapizan nuestra boca y nariz. Una vez en el interior del cuerpo el virus presenta una tasa de replicación altísima; se ha llegado a encontrar más de un millón de moléculas de ARN en un solo hisopado nasofaríngeo. Dado este contexto, no es difícil para el virus llegar a lo más profundo de las vías aéreas, los sacos alveolares del pulmón, donde infecta a los neumocitos (las células del epitelio respiratorio).
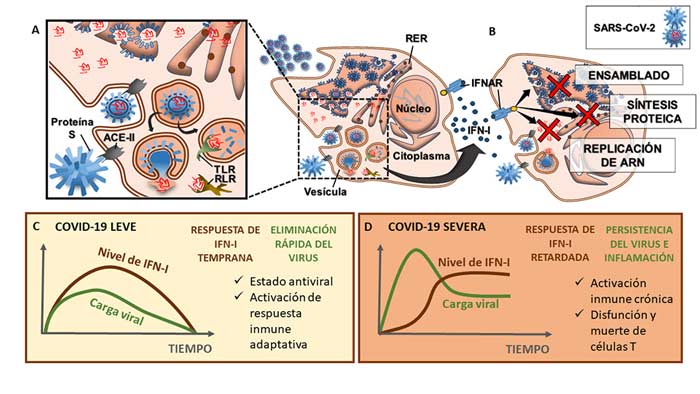
El ingreso de SARS-CoV-2 a los neumocitos está mediado por uniones muy específicas entre la proteína S y proteínas de la membrana plasmática de la célula hospedadora: la enzima convertidora de angiotensina II (ACE II). Esta interacción, si bien clave, requiere la acción de otras proteínas, como la proteasa TMPRSS2, que activa a la proteína S, facilitando la entrada del virus al interior de la célula. ACE II es una molécula presente en muchos tipos celulares, cumpliendo funciones fisiológicas, y el virus la aprovecha como puerta de ingreso a la célula.
Es en ese momento, en el interior de la célula, cuando se activan las primeras herramientas del sistema inmunológico: el sistema inmune innato.
Se encienden las alertas contra el virus: el sistema inmune innato entra en acción
La primera rama del sistema inmune que responde frente a la entrada de un agente extraño o agresor son las células y mediadores del denominado sistema inmune innato. Este sistema es la primera línea de defensa contra las infecciones y es filogenéticamente la parte más antigua del sistema inmune. Se cree que coevolucionó con los microbios para proteger a todos los organismos multicelulares de las infecciones, y que apareció hace 750 millones de años. Esta rama de la respuesta inmune incluye células y moléculas que preexisten a la infección y que están preparadas para responder a las pocas horas. Además, esencialmente responde de la misma manera a exposiciones repetidas, sin cambiar en calidad o en magnitud.
Está constituido por células tales como macrófagos, neutrófilos, monocitos, células citotóxicas naturales (natural killer o NK), entre otras, algunas circulando en sangre, otras presentes en los distintos tejidos. Además, incluye a muchas citoquinas, proteínas solubles que actúan como mensajeros entre células, encargadas de regular y coordinar muchas actividades fundamentales.
Los neumocitos infectados por el SARS-CoV-2 son células vitales porque intervienen en la respiración, pero no son células especializadas del sistema inmune innato. Sin embargo, comparten algunas características con ellas, ya que son capaces de activarse y ejecutar un programa de defensa al reconocer el ARN viral en su interior. Dado que muchos otros virus también poseen ARN, una estructura molecular que se ha conservado en la historia evolutiva de los virus, estos sistemas de defensa lo reconocen independientemente de las diferencias entre sus secuencias, identificando estructuras moleculares comunes a determinados grupos de agentes infecciosos. Así, el ARN viral es rápidamente reconocido como peligroso por estos receptores expertos en detectar su presencia: los receptores tipo Toll (TLR, del inglés Toll-like receptors) y tipo RIG (RLR, del inglés Retinoic acid inducible genes like receptors) (figura 1). Este encuentro inicia la respuesta inmune antiviral y la generación de los interferones tipo I (IFN-I), citoquinas especializadas en ‘interferir’ con la replicación viral (y de ahí su nombre). Así, se evita que las células vecinas sean invadidas y convertidas en fábricas de virus, incapaces de cumplir con sus funciones vitales. La calidad y rapidez con la que se desata esa primera ola de IFN-I es crucial para el control de la reproducción viral y por ende en el devenir de la enfermedad (figura 1). No se sabe exactamente qué receptores están involucrados en el reconocimiento inicial de SARS-CoV-2, pero la magnitud y el momento en el que se gatilla esta respuesta de IFN-I están en el foco de numerosas investigaciones.
Las células infectadas no están solas en su lucha: las acompañan los macrófagos alveolares, células especializadas de la inmunidad innata que residen en el pulmón y que rápidamente detectan la agresión, activándose y liberando citoquinas ‘proinflamatorias’, que alertan al organismo de la existencia del peligro. Entre ellas, están TNF, IL-1β e IL-6 que activan la generación de fiebre y atraen al pulmón otras células del sistema inmunológico como neutrófilos y linfocitos. Comienzan a reclutarse células de la sangre al pulmón, como monocitos y neutrófilos, quienes liberarán sustancias muy agresivas, tales como especies reactivas de oxígeno, leucotrienos y enzimas proteolíticas que forman parte de la respuesta inflamatoria orientada a controlar la agresión viral. Si esta reacción inflamatoria inicial no elimina al virus lo suficientemente rápido o no es controlada por mecanismos regulatorios, las células sanas pueden sufrir catastróficos daños colaterales.
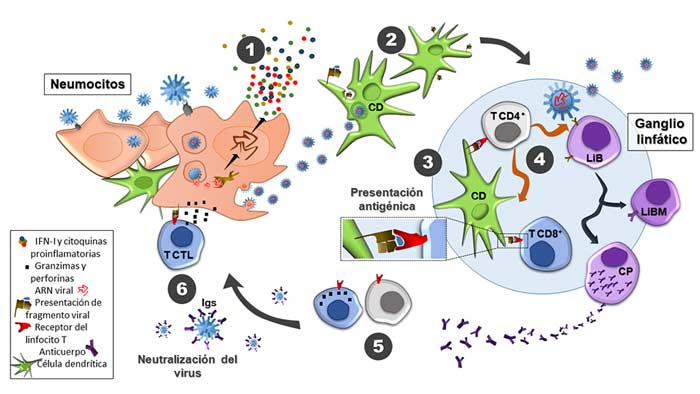
Entre las células de la inmunidad innata, están las células dendríticas (CD, figura 2), que (al igual que los macrófagos antes mencionados) residen en los diferentes órganos y tejidos y funcionan como centinelas, capturando partículas virales que digieren en pequeños fragmentos. Así, estas células dendríticas se cargan de estos pequeños fragmentos virales y los transportan al ganglio más cercano para mostrárselos expuestos en su superficie a los linfocitos T y así activarlos, en un proceso conocido como presentación antigénica (figura 2). Las células dendríticas son claves como nexo entre la respuesta inmune innata y la segunda línea de defensa contra la infección: el sistema inmune adaptativo.
La respuesta antiviral se perfecciona: se activa el sistema inmune adaptativo
La respuesta inmune adaptativa lleva más tiempo en orquestarse debido a que las células que la componen, los linfocitos, detectan detalles finos de la estructura molecular de, por ejemplo, un patógeno, lo cual les permite distinguir sutiles diferencias entre microorganismos muy parecidos. En ese sentido, y considerando que los requerimientos para su ‘encendido’ son más complejos, es una respuesta más lenta pero que permite el desarrollo de una respuesta inmunológica mucho más exitosa. Además, el sistema adaptativo, conformado por los linfocitos T y B, posee memoria: es capaz de ir creciendo en magnitud y en capacidad de defensa con cada reexposición a la agresión. Si bien los linfocitos tienen la capacidad de reconocer detalles finos de la estructura de un virus en particular, puede suceder que si, por ejemplo, un paciente se ha infectado con un virus A y al cabo de un tiempo se encuentra con un virus B muy similar, el sistema adaptativo se ‘confunda’ y reaccione como si fuera el segundo encuentro con A, respondiendo con la magnitud característica de un segundo encuentro. Esto se conoce como reactividad cruzada. En el caso del SARS-CoV-2, se ha descripto que linfocitos que se han activado frente a otros coronavirus causantes de resfríos comunes pueden reactivarse frente a SARS-CoV-2 (al menos in vitro), aunque el impacto de este hecho en el desarrollo de la enfermedad no se conoce con certeza.
Entre los linfocitos T, la subpoblación de células T CD8+ (figura 2) cumple un rol primordial en la defensa antiviral porque, ante una célula infectada, la detecta e induce su muerte, sin dañar a las células vecinas sanas. Para que esto ocurra eficientemente estas células T CD8+ citotóxicas (CTL, del inglés cytotoxic T lymphocytes, figura 2) tienen que haber visto fragmentos virales presentados por una célula dendrítica en el ganglio más cercano y haber recibido la ayuda de otra población de células T: las células T CD4+ cooperadoras. Una vez activadas en el ganglio linfático, migran al sitio de infección, donde las células T CD8+ CTL reconocen a la célula infectada, generando poros en su membrana e induciéndole su muerte (figura 2).
Otros grandes actores de la inmunidad adaptativa son los linfocitos B (LiB, figura 2), que inmediatamente después de la identificación del agente agresor comienzan un proceso de transformación o diferenciación a células plasmáticas (CP, figura 2), verdaderas fábricas productoras de anticuerpos o inmunoglobulinas (Igs, figura 2). Así, las células plasmáticas liberan los anticuerpos a los líquidos biológicos. Las Ig se adhieren a las partículas virales neutralizándolas e impidiendo su ingreso a las células del organismo. En el ser humano, estas Ig pueden ser de cinco tipos diferentes, cada uno con funciones y ubicaciones características: IgM, IgG, IgA, IgE e IgD. El primer tipo de anticuerpo que aparece en sangre a la semana aproximadamente de la infección con cualquier organismo es la IgM, seguida por la IgG que aparece un poco más tardíamente. La IgA también se encuentra en sangre, pero es más abundante en saliva y en otras secreciones mucosas. El SARS-CoV-2 provoca una respuesta rápida de linfocitos B, como lo demuestra la detección de anticuerpos de tipo IgM, IgG e IgA, aunque se ha descripto que IgM e IgG pueden aparecer simultáneamente, o en algunos casos el proceso de respuesta directamente produce IgG.
La respuesta de los linfocitos T y B a un virus sirve no solo para proteger del desafío inicial, sino también para ofrecer inmunidad extendida contra la reinfección. En efecto, cuando los linfocitos reconocen a un determinado patógeno, se gatillan una serie de eventos moleculares que promueven la memoria inmunológica: generación de poblaciones de linfocitos con mayor vida media, una ubicación particular en los distintos tejidos y una capacidad de acción más rápida y eficiente. Por ejemplo, después de la resolución de una infección, las células plasmáticas formadas al inicio de la infección y durante el período convaleciente continúan secretando anticuerpos por un período extendido de tiempo. Además de las células plasmáticas especializadas en la producción de anticuerpos, existen células B de memoria, de larga vida media, que también se forman durante la infección primaria y que constituyen el segundo brazo de la memoria humoral (LiBM, figura 2). Estas células B de memoria pueden responder rápidamente a una reinfección generando nuevas células plasmáticas. A largo plazo, la protección contra una reinfección se logra mediante la inducción de células plasmáticas de larga duración y células B y T de memoria. En el caso de la infección con SARS-CoV-2 queda el interrogante si este puede gatillar estos procesos y, por ende, por cuánto tiempo una persona recuperada estará protegida frente a esta misma infección en el caso de un nuevo brote. Del mismo modo, todavía no se puede determinar con certeza el tipo y la duración de la memoria inmunológica que se induciría con las vacunas que actualmente se están testeando.
Estos mecanismos inmunológicos funcionan adecuadamente y en forma concertada en la gran mayoría de los pacientes con COVID-19 leve, eliminando el virus que los asedia (figura 1C). A medida que se controla la infección, normalmente hay un punto de inflexión asociado con la entrada en una fase de resolución y reparación del tejido dañado y lentamente se vuelve a la homeostasis.
El problema en la COVID-19 severa: el descontrol del sistema inmunológico
En más del 80% de los pacientes de COVID-19 la respuesta inmune antiviral, principalmente la respuesta mediada por IFN-I y células T CD8+, es muy efectiva, y la enfermedad transcurre con síntomas leves o de manera asintomática. Sin embargo, en la población de riesgo (mayores de sesenta y cinco años y pacientes inmunocomprometidos o con comorbilidades –patologías preexistentes que pueden agravar la enfermedad, como diabetes, obesidad severa, enfermedades cardiovasculares o hipertensión–) todo parece indicar que la respuesta inicial de IFN-I es débil o se inicia demasiado tarde, cuando el virus se replicó demasiado. Además, se sabe que los coronavirus han desarrollado muchos mecanismos para evadir la acción de los IFN-I, que sumados al deterioro inmunológico de estos pacientes pueden agudizar la severidad de la enfermedad (figura 1D).
Se ha visto que pacientes con COVID-19 severa, al igual que con otras infecciones respiratorias, cursan con un número disminuido de linfocitos T en sangre, lo que se denomina linfopenia. No se conocen exactamente las causas de esta linfopenia, ya que no hay evidencias ciertas de que los linfocitos T sean infectados con el virus, pero sí se ha observado presencia de marcadores indicativos de muerte celular en ganglios y en bazo, órganos donde residen muchas poblaciones inmunológicas. Otras hipótesis sugieren que el bajo número de linfocitos en sangre se debe a un reclutamiento masivo de estas células al sitio primario de infección. Lo cierto es que la causa de esta marcada linfopenia es controvertida. Por otro lado, dicha linfopenia es más severa cuanto más elevados sean los niveles de IL-6 y de otros marcadores inflamatorios que se pueden medir fácilmente en un laboratorio de análisis clínico. Los niveles de estos parámetros en sangre son marcadores de la severidad de la enfermedad, ya que se asocian a un mal pronóstico.
En la primera fase de la infección, denominada fase viral, se puede detectar la presencia del ARN viral en los hisopados nasofaríngeos, a través de la técnica de PCR. Algunos pacientes que no pueden controlar la infección exitosamente van a entrar en lo que se denomina la fase pulmonar, cursando con neumonía, que se puede complicar con infecciones bacterianas. Pero el problema más grave se suscita en la población de riesgo.
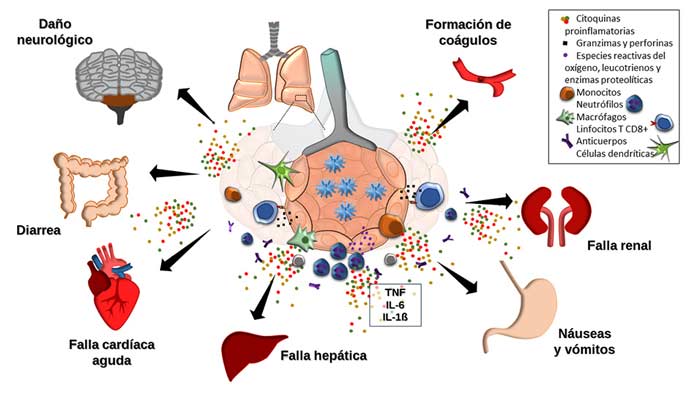
Además de esta linfopenia marcada, los estudios recientes sugieren que los casos fatales asociados a SARS-Cov-2 se deben a la activación descontrolada principalmente del sistema inmune innato y no al daño ocasionado por el virus. Los niveles de citoquinas proinflamatorias en sangre tales como IL-6, TNF, IL-1β están sumamente elevados, lo que se conoce como síndrome de liberación de citoquinas o tormenta de citoquinas, que se caracteriza por fiebre persistente e inflamación generalizada y progresiva. En este contexto, la insuficiencia respiratoria es lo más prominente, pero también el corazón, el sistema nervioso central y los riñones se verán afectados, lo que se denomina síndrome de dificultad respiratoria aguda y síndrome de falla multiorgánica (figura 3). Así, en los pacientes no tratados la tormenta de citoquinas suele ser mortal. El dosaje de IL-6 es entonces de crucial importancia, ya que sus niveles elevados se asocian con la gravedad de la enfermedad. Esta fase se suele denominar fase hiperinflamatoria.
Para empeorar la situación, esta inflamación exacerbada impacta en las células endoteliales (es decir, las células que cubren los vasos sanguíneos), activándose la cascada de coagulación y promoviéndose la generación de coágulos asociada a los niveles elevados de citoquinas proinflamatorias.
No se sabe por qué algunos pacientes transitan a la forma severa de la enfermedad ni por qué se desencadena la tormenta de citoquinas, pero es decisivo lograr predecir qué pacientes van a desarrollarla para así establecer una terapia adecuada. Recientemente, el uso de dexametasona (un corticoide habitual en la práctica médica con potente efecto antiinflamatorio) redujo la mortalidad en los pacientes más graves, así como también la utilización de fármacos que bloquean la IL-6 ha resultado alentadora.
Si bien la humanidad a lo largo de su historia ha sufrido numerosas plagas inmortalizadas en inolvidables obras de arte y literatura, la pandemia que nos toca vivir es única por la gigantesca conectividad de nuestro mundo actual; del mismo modo es inigualable el esfuerzo científico para lograr la inmunidad tan esperada frente a SARS-CoV-2. La enorme experiencia acumulada en entender nuestro sistema inmunológico y las infecciones con otros coronavirus nos permiten hoy avizorar con esperanza la llegada en tiempo récord de las tan ansiadas vacunas.
LECTURAS SUGERIDAS
ALTMANN DM & BOYTON RJ, 2020, ‘SARS-CoV-2 T cell immunity: Specificity, function, durability, and role in protection’, Science Immunology, 17, 5: 2350.
BAUMGARTH N et al., 2020, ‘Antibody responses to SARS-CoV-2: Let’s stick to known knowns’, The Journal of Immunology, 205, 9: 2342-2350.
PARK A e IWASAKI A, 2020, ‘Type I and Type III Interferons: Induction, signaling, evasion, and application to combat COVID-19’, Cell Host & Microbe, 27: 870-878.
VABRET N et al., 2020, ‘Immunology of COVID-19: Current state of the science’, Immunity, 52, 6: 910-941.
WIERSINGA WJ et al., 2020, ‘Pathophysiology, transmission, diagnosis, and treatment of Coronavirus Disease 2019 (COVID-19). A review’, JAMA, DOI 10.1001/jama.2020.12839.













